Квартет здоровья – новая концепция современной профилактической и эстетической медицины: витамин D, возможности внутреннего и наружного применения
Традиционные представления о витамине D связаны, прежде всего, с его ключевой ролью в кальциево-фосфорном обмене и влиянии на минеральную плотность костной ткани. В последнее время произошло обогащение существующих представлений, и сегодня известно, что витамин D является по сути стероидным гормоном, обладающим целым рядом важных эффектов на различные органы и ткани, которые крайне необходимы для обеспечения широкого спектра физиологических процессов и оптимального состояния здоровья человека. Сегодня активно изучается возможность местного применения препаратов с витамином D для профилактики и лечения ряда кожных заболеваний. О новых исследованиях и подходах использования витамина D в дерматологии, косметологии и anti-age медицине и рассказывается в данной статье.
Введение
В последнее десятилетие интерес к антивозрастной медицине и косметологии существенно вырос. И это вполне понятно, так как ожидаемая продолжительность жизни населения Земли неуклонно растет и в целом ряде стран уже превышает 80 лет. Соответственно, увеличивается и количество возраст-ассоциированных болезней (так называемых болезней цивилизации), а у людей по.является естественное желание как можно дольше оставаться здоровыми, активными и красивыми. Крепкое здоровье, высокая стрессоустойчивость и работоспособность, внешняя привлекательность и свежесть — имен.но ради этих составляющих биологической молодости люди тратят немалые ресурсы на борьбу со старением. Наконец-то человечество пришло к пониманию, что красота и молодость зависят не только от косметических средств, которые мы используем наружно, ученые до.казали: красота идет изнутри. Регулярная физическая активность, рациональное питание с высоким содержанием пищевых волокон и витаминов, отказ от вредных привычек — основа хорошего самочувствия и долголетия. Однако в современном постоянно меняющемся мире этого оказывается недостаточно.
Концепция «квартета здоровья»
Основываясь на понимании патогенетических механизмов клеточного старения и развития основных болезней цивилизации — ожирения, атеросклероза, артериальной гипертонии и сахарного диабета 2-го типа, мы сформулировали концепцию «квартета здоровья» — комплексной метаболической терапии.
 Табл. 1. Формы и метаболиты витамина D в организме человека
Табл. 1. Формы и метаболиты витамина D в организме человекаПонятие «метаболическая терапия» подразумевает лечение, направленное в первую очередь на поддер.жание или восстановление структурной целостности и физиологических функций клетки как наименьшей еди.ницы живого, ведь от этого во многом зависит структура тканей и организма в целом. Термин «метаболическая» подчеркивает характер терапии, направленной на восста.новление гормонально-биохимического фона, соответ.ствующего 30–35-летнему возрасту человека.
Компонентами квартета здоровья являются:
- половые гормоны (поддержание их физиологического уровня, заместительная гормональная терапия при их дефиците);
- витамин D (поддержание его физиологического уровня);
- омега-3 полиненасыщенные жирные кислоты (ПНЖК);
- тиоктовая, или α-липоевая, кислота (АЛК).
Каждый компонент квартета здоровья обоснован и одинаково важен. В настоящее время в современной литературе активно обсуждается заместительная гормональная терапия, терапия препаратами омега-3 ПНЖК, расширяются показания к назначению тиоктовой кислоты и растет интерес к коррекции дефицита витамина D.
Метаболизм и основные эффекты витамина D
Традиционные представления о витамине D связаны прежде всего с его ключевой ролью в кальциево-фосфорном обмене и влиянии на минеральную плотность костной ткани [1]. Несмотря на то что эти «классические» функции витамина D были известны достаточно давно (профилактика рахита у детей, профилактика и лечение остеопороза у взрослых), в последнее время произошло обогащение существующих представлений, и сегодня известно, что витамин D является по сути стероидным гормоном, обладающим целым рядом важных эффектов на различные органы и ткани, которые крайне необходимы для обеспечения широкого спектра физиологических процессов и оптимального состояния здоровья человека.
Под термином «витамин D» мы понимаем целую группу веществ. Лучше всего нам знакомы холекальциферол (витамин D3) и эргокальциферол (витамин D2). Витамин D3 синтезируется в коже человека и животных из 7-дегидрохолестерола (производного холестерина, 7-DHС) под воздействием ультрафиолетовых В лучей (УФ-В) солнечного света и поступает в организм в основном из пищевых продуктов животного происхождения (рыбий жир, сливочное масло, яйца, молоко). Витамин D2 можно получить только из пищи растительного происхождения (дрожжи, хлеб, грибы, некоторые овощи).
Витамины D2 и D3 биологически инертны. Для активации и превращения в активную форму D-гормона в организме должны пройти два процесса химического превращения (гидроксилирования). Первый происходит преимущественно в печени и превращает витамин D3 в 25-гидроксивитамин D [25(OH)D], также известный как кальцидол. Второе гидроксилирование происходит преимущественно в почках с участием фермента CYP27B1 — альфа-гидроксилазы, и его результатом является синтез биологически активного 1,25-дигидроксивитамина D [1,25(OH)2D] или кальцитриола [2]. Ограничению образования активной формы витамина способствует стимуляция фермента CYP24A1 (24-гидроксилазы), который превращает кальцитриол в неактивную, водорастворимую форму кальцитроевой кислоты, в дальнейшем выводимой из организма с желчью (табл. 1, рис. 1) [1, 5].
В отличие от витаминов в активной форме витамина D (1,25(OH)2D, или кальцитриолу) в клетках различных органов и тканей выявлены специфические рецепторы (Vitamin D Receptors, или VDR), что позволяет классифицировать витамин D как D-гормон, функции которого со.стоят в способности генерировать и модулировать биологические реакции в тканях-мишенях за счет регуляции транскрипции генов [3, 4].
VDR относится к семейству ядерных рецепторов, необходимых для реализации действия стероидных гормонов (включая тестостерон, эстрадиол, кортизол, альдостерон). Содружественным VDR-рецептору является ретиноидный X-рецептор (RXR) — ядерный рецептор к витамину А. Образованный этими двумя рецепторами комплекс VDR-RXR в присутствии активной формы витамина D [1,25(OH)2D] связывается с соответствующим участком генома и запускает механизм транскрипции генов с последующей трансляцией соответствующих белковых молекул. Таком образом, замыкается цепь — воздействие витамина D приводит к синтезу конкретных белков, определяющих течение метаболических процессов в клетках и тканях (рис. 1) [5–8].
Выявление и изучение локуса ДНК, к которому прикрепляется комплекс VDR-RXR (ассоциированный с 1,25D), позволило расшифровать многие гены, которые имеют отношение к реализации воздействия витамина D. Часть генов активизируется непосредственно и быстро, часть — опосредованно и в течение определенного промежутка времени, от нескольких часов до нескольких суток [7, 8]. В целом D-гормон регулирует экспрессию около 3% всего генома человека (свыше 1000 генов, локализованных в разных хромосомах) [5, 8, 9].
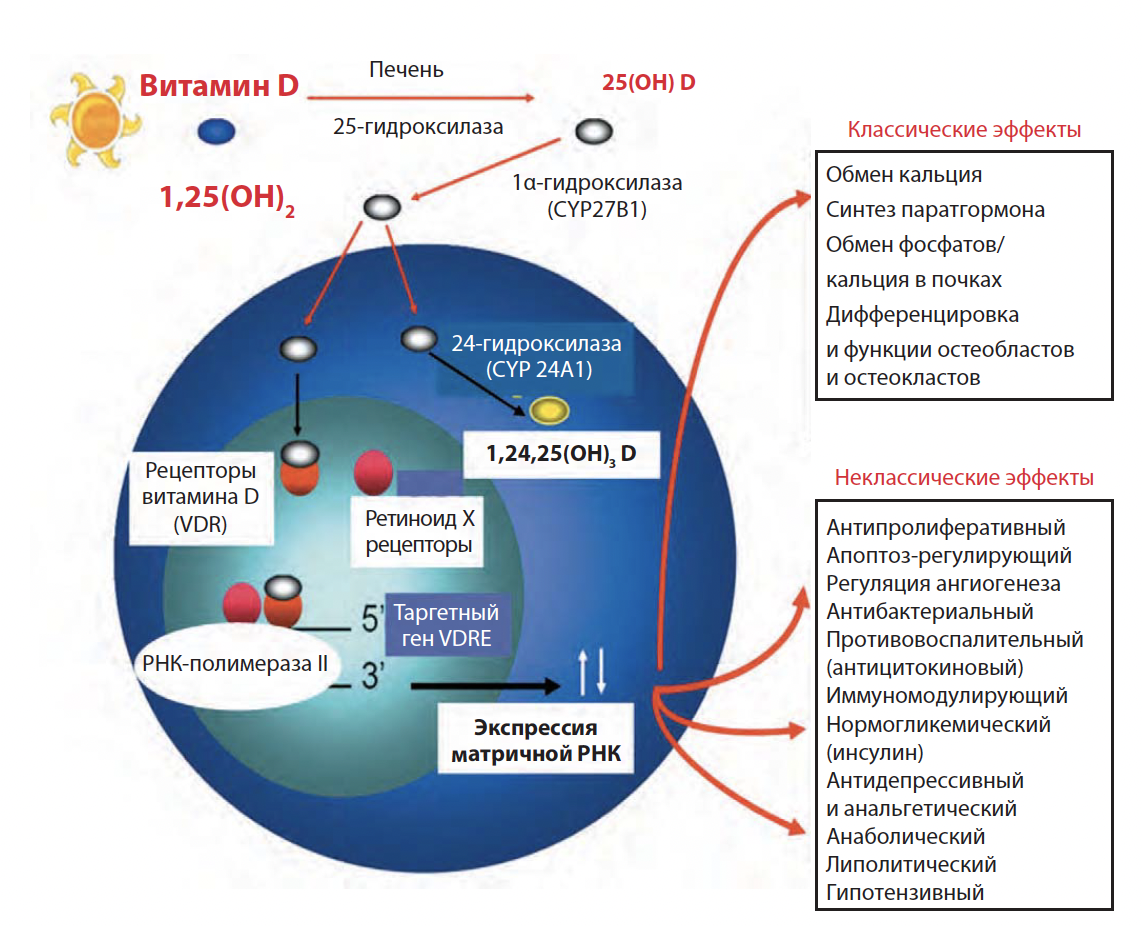 Рис. 1. «Классические» и «неклассические» эффекты витамина (гормона) D [1, 2, 5]
Рис. 1. «Классические» и «неклассические» эффекты витамина (гормона) D [1, 2, 5] Принято выделять «классические» эффекты D-гормона, связанные с его влиянием на кальциево-фосфорный обмен и минеральную плотность костной ткани, и «неклассические» биологические эффекты. К «неклассическим» эффектам D-гормона относят торможение клеточной пролиферации и ангиогенеза, стимуляцию продукции инсулина и кателицидинов (противомикробных пептидов), ингибирование продукции ренина, противовоспалительный, антибактериальный, противораковый, антигипертензивный и целый ряд других физиологических эффектов [1, 2, 5] (рис. 1).
Роль витамина D в патогенетических механизмах возраст-ассоциированных заболеваний
Новые представления о витамине D как о мощном стероидном гормоне привели к существенной переоценке его физиологической роли в организме человека в разные периоды его жизни. Оказалось, что достаточный уровень D-гормона необходим человеку на протяжении всей жизни — от периода новорожденности до самой глубокой старости, поскольку он регулирует крайне важные гены, отвечающие за синтез половых гормонов и регуляцию углеводного обмена, нарушение функции которых закономерно сопровождаются низкой продолжительностью и качеством жизни.
Сегодня дефицит витамина (гормона) D — это новая метаболическая пандемия XXI в. Особенно подвержены развитию дефицита витамина D люди, проживающие севернее 35-й параллели (в Северном полушарии), что обусловлено недостаточным уровнем инсоляции большую часть года (рис. 2) [2].
У жителей северных стран, характеризующихся существенными сезонными различиями естественной инсоляции, наблюдается снижение уровня витамина D в крови в темные зимние месяцы и пик его концепции в течение лета. Наиболее остро дефицит витамина D проявляется ранней весной, когда отмечается обострение многих заболеваний, в том числе аутоиммунных [10].
Как видно из рис. 2, в зону риска дефицита/недостаточности витамина D попадают жители всей территории России, Европы, практически всей Северной Америки, что неудивительно, т.к. угол падения УФ-В лучей в этих регионах земного шара не позволяет полноценно использовать механизм синтеза витамина D3 в коже.
 Рис. 2. Географические зоны риска дефицита/недостаточности витамина (гормона) D [2]
Рис. 2. Географические зоны риска дефицита/недостаточности витамина (гормона) D [2]Современные данные о распространенности дефицита витамина D в популяции жителей Земли неоднозначны, что во многом объясняется географией района исследования, особенностями и уровнем годовой инсоляции, климатом, характером и привычками питания местных жителей и т.д. Однако, согласно данным достоверных исследований, в том числе и российских, можно утверждать, что не менее 50% населения земного шара имеют недостаточность витамина D [11–13].
В группе риска по развитию дефицита витамина D находятся:
- грудные младенцы;
- пожилые люди;
- люди с ограниченным пребыванием на солнце;
- темнокожие люди;
- люди с ожирением;
- люди с заболеваниями, сопровождающимися нарушением всасывания жиров, в том числе перенесшие операции шунтирования желудка [2].
С возрастом количество людей в мире с дефицитом витамина D увеличивается до 80–90% [2]. Более того, с возрастом происходит снижение уровня витамина D даже у людей, проживающих в регионах с достаточным уровнем инсоляции. В первую очередь, это связано со снижением содержания предшественника витамина D3 — 7-дегидрохолестерола (7-DHС) в коже пожилых людей.
Таким образом, с увеличением возраста современного человека частота и степень выраженности дефицита/недостаточности витамина D неуклонно увеличиваются, что сопровождается развитием разнообразных возраст-ассоциированных заболеваний. Последние эпидемиологические и экспериментальные данные показали, что низкий уровень витамина D тесно связан с высоким риском общей смертности, сердечно-сосудистыми и онкологическими заболеваниями (в основном раком молочной железы, простаты и толстого кишечника), саркопенией (дефицитом мышечной массы), ожирением, метаболическим синдромом, а также инсулинорезистентностью и сахарным диабетом (СД) 1-го и 2-го типов у взрослых людей (табл. 2) [14–23].
Наиболее адекватным методом оценки достаточности витамина D является определение в крови его промежуточного метаболита 25-гидроксивитамина D [25(OH) D], который в полной мере отражает суммарное количество витамина D, производимого в коже из 7-DHC под действием УФ-В лучей и получаемого из пищевых продуктов и пищевых добавок, и имеет довольно продолжительный период полураспада в крови — порядка 15 дней [2]. Золотым стандартом определения концентрации 25(ОН)D в крови во всем мире является метод тандемной хромато-масс-спектрометрии (мультистероидный анализ), который позволяет максимально точно (в отличие от наиболее распространенного радиоиммунного анализа) выявить дефицит или недостаточность витамина D.
Дефицит витамина D, включая мнение экспертов Международного эндокринологического общества [2], определяется как уровни 25(OH)D в сыворотке крови менее 20 нг/мл (50 нмоль/л). Многие эксперты считают, что уровни между 20–30 нг/мл (50–75 нмоль/л) должны расцениваться как «недостаточность» витамина D, а оптимальный уровень 25(OH)D составляет более 30 нг/мл (75 нмоль/л).
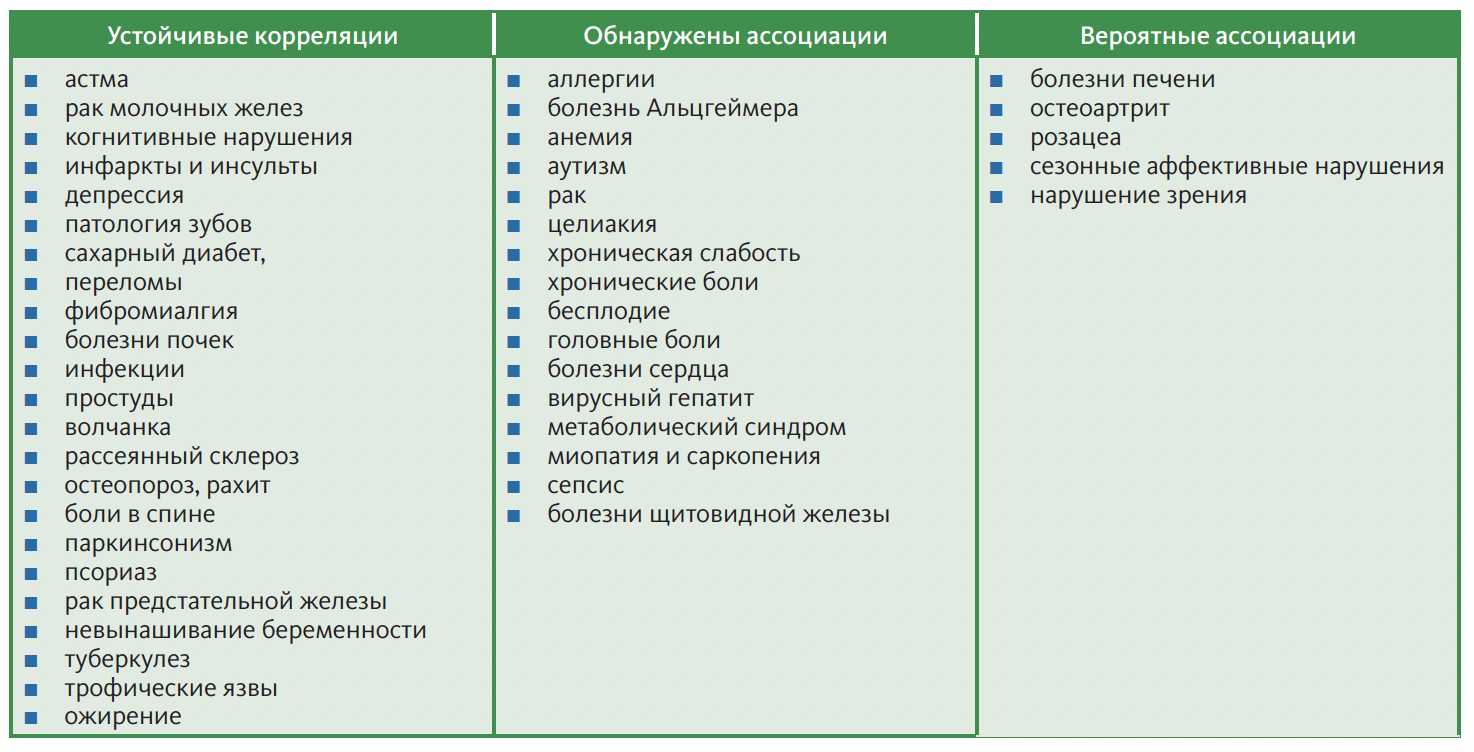 Табл. 2. Корреляционные связи между недостаточностью витамина (гормона) D и возраст-ассоциированными заболеваниями [2, 14–23]
Табл. 2. Корреляционные связи между недостаточностью витамина (гормона) D и возраст-ассоциированными заболеваниями [2, 14–23] Однако уже сейчас существует целый ряд исследований, демонстрирующих значительные преимущества в отношении здоровья и качества жизни при достижении более высоких уровней 25(OH)D [24, 25]. Согласно рекомендациям The Vitamin D Society, канадского общества экспертов по изучению витамина D, оптимальным уровнем 25(OH)D в сыворотке крови можно считать 100–150 нмоль/л (40–60 нг/ мл). Только достижение такой концентрации 25(OH)D позволит снизить риск возраст-ассоциированных заболеваний, таких как остеопороз, сахарный диабет 2-го типа, различные виды онкологических заболеваний и увеличить продолжительность жизни [26].
Витамин D как составляющая «квартета здоровья»
Включение терапии препаратами витамина D в комплекс терапевтических мероприятий при лечении возраст-ассоциированных заболеваний существенно повышает эффективность такой терапии, потому что делает ее патогенетически обоснованной. Поэтому сегодня при всех возраст-ассоциированных заболеваниях необходимо проводить активный лабораторный скрининг дефицита/недостаточности витамина D и максимально рано начинать их фармакологическую коррекцию с быстрым достижением компенсации (целевых значений плазменного уровня 25(ОН) D не менее 40 нг/мл) и дальнейшим переводом пациентов на поддерживающую пожизненную терапию [27, 28].
В настоящее время получены убедительные данные, подтверждающие необходимость назначения препаратов витамина D при лечении не только остеопороза, но и других возраст-ассоциированных заболеваний. Эффекты D-гормона многогранны, поэтому спектр показаний к назначению терапии витамином D в последнее время расширяется.
На сегодняшний момент существует большое количество исследований с высокой степенью доказательности, демонстрирующих позитивные эффекты восполнения дефицита витамина D у больных с ожирением и метаболическим синдромом, сахарным диабетом 1-го и 2-го типов, хроническим заболеваниями почек, болезнью Альцгеймера и другими формами старческого слабоумия, у больных с заболеваниями печени и депрессией, при болезни Паркинсона, рассеянном склерозе, шизофрении и др. [29–33, 38–41]. Есть убедительные данные о противораковых эффектах витамина D, о чем свидетельствует наличие достоверной обратной связи между его плазменным уровнем и частотой таких раков, как рак легких, молочной железы, предстательной железы. Восполнение дефицита витамина D уменьшает риски общей и кардиоваскулярной смертности [34–36].
Таким образом, восполнение дефицита витамина D с помощью препаратов витамина D в настоящее время является практически необходимым условием достижения и поддержания нормальной концентрации 25(OH)D в сыворотке крови. Согласно рекомендациям международных экспертов, для профилактики и лечения дефицита витамина D применяется холекальциферол (витамин D3), реже используются препараты эргокальци.ферола (витамин D2) [2]. Подбор оптимальной дозы вита.мина D проводится в зависимости от исходной концентрации 25(OH)D в сыворотке крови, измерение которой является обязательным компонентом подбора начальной дозы и исследования достаточности компенсации дефицита на фоне проводимой терапии.
В различных странах рекомендуемое суточное потребление витамина D3 составляет 400–600 МЕ/сут для взрослых. В настоящее время ведется активное обсуждение необходимости повышения суточной дозировки витамина D до 2000–4000 МЕ/сут, а для лечения ожирения могут потребоваться дозы порядка 6000–10 000 МЕ/сут [2]. Долговременное поддержание оптимальной физиологической концентрации витамина D в крови является физиологической и патогенетической стратегией при лечении любых возраст-ассоциированных заболеваний.
Витамин D и здоровье кожи в норме и при старении
Современные исследования свидетельствуют не только об участии кожи в обмене витамина D (что известно относительно давно), но и о важном участии витамина D в жизнедеятельности эпидермиса.
Кератиноцит эпидермиса человека является единственной клеткой организма, оснащенной полным набором ферментов, необходимых для собственной трансформации провитамина D [7-DHC] до итоговой формы D-гормона [1,25(OH)2D]. Этот каскад запускается УФ-В лучами солнечного света и развивается теми же гидроксилазами, что и в клетках печени и почек (рис. 3). Следует отметить, что меланин конкурирует с 7-DHC в поглощении УФ-излучения для своего синтеза и таким образом действует как естественный солнцезащитный экран, снижая эффективность образования витамина D. Поэтому людям с темной кожей, для того чтобы синтезировать такое же количество холекальциферола, как у людей со светлой кожей, требуется почти в несколько раз больше времени пребывания на солнце [42–46].
Некоторая часть образовавшегося в коже холекальциферола может изомеризоваться с образованием фотопродуктов — тахистерола или люмистерола. Оба изомера биологически неактивны и практически не попадают в кровоток. По-видимому, этот защитный механизм предотвращает токсическое воздействие витамина D, который мог бы образоваться в избыточных количествах при длительном пребывании на солнце. Даже при пролонгированном облучении уровень холекальциферола в кератиноците не превышает 10–15% от содержания 7-DHC. Уровень витамина D3, образующегося под воздействием солнечных лучей, также может быть снижен благодаря синтезу других фото.продуктов, в том числе 5,6-транс-витамина-D3, супрастерола I и супрастерола II. Как и D-гормон, некоторые из упомянутых фотопродуктов могут регулировать пролиферацию и дифференцировку эпидермиса, но выяснение их биологического значения требует дальнейшего изучения [42–46].
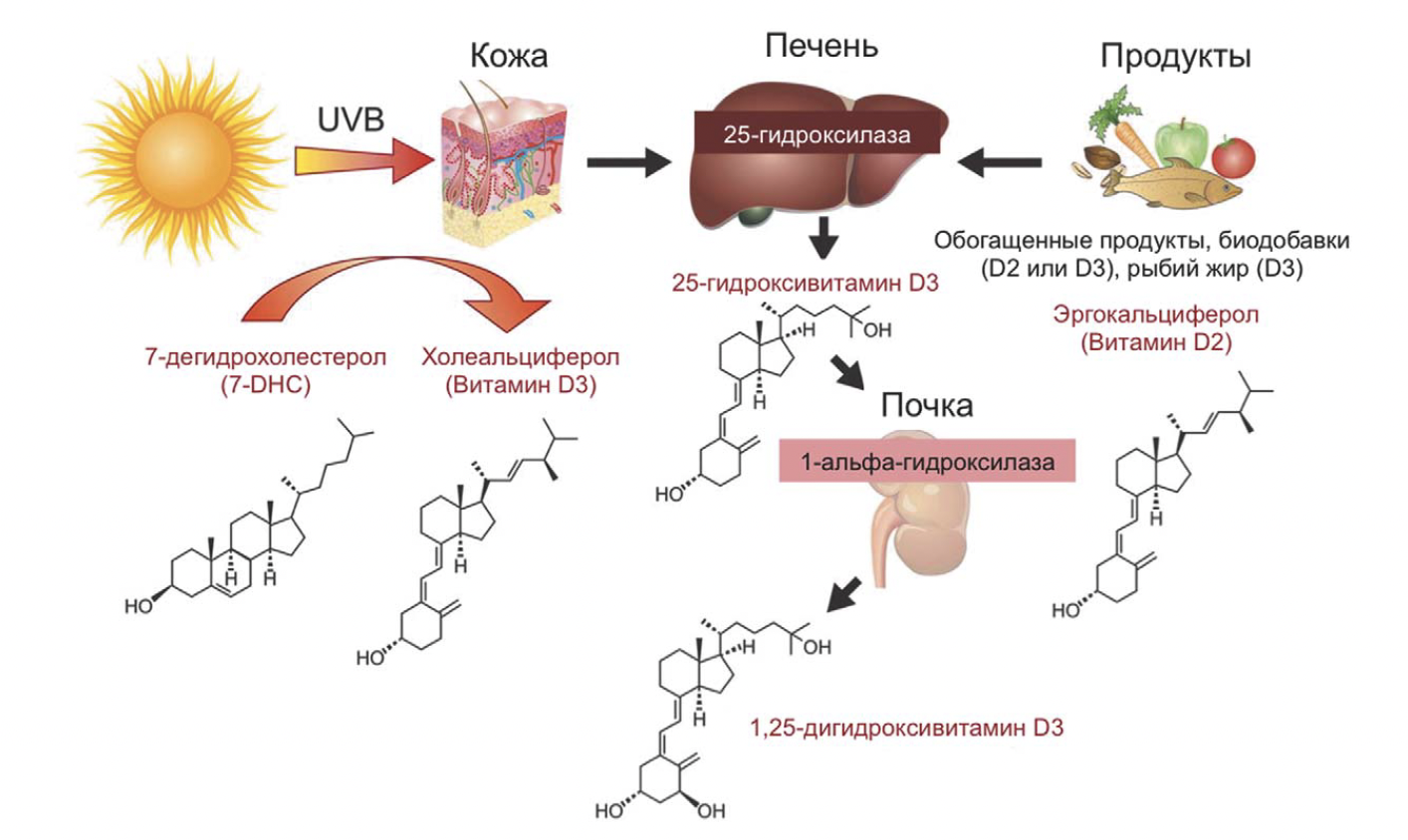 Рис. 3. Схема биосинтеза витамина (гормона) D [47, 48]
Рис. 3. Схема биосинтеза витамина (гормона) D [47, 48] На образование витамина D3 влияют все факторы, каким-либо образом воздействующие на количество солнечных УФ-B фотонов, которые проникают в кожу, или изменяющие количество 7-DHC в коже. Количество 7-DHC в эпидермисе не является постоянной величиной, по мере старения его уровень начинает снижаться. При действии одного и того же количества света на человека 70 лет и человека 20 лет в коже 70-летнего образуется в 4 раза меньше витамина D3, чем у 20-летнего [51].
Биологический смысл наличия в коже полного набора ферментных систем для превращения провитамина D в D-гормон заключается в следующем. Кератиноциты — это пул клеток с высокой скоростью деления на фоне интенсивного воздействия внешних стресс-факторов [57–59]. Реализация механизмов, ассоциированных с витамином D, позволяет:
- защитить клетки от гибели и/или апоптоза;
- cтабилизировать скорость деления клеток;
- «запретить» деление поврежденных клеток;
- повысить выработку «натуральных антибиотиков».
УФ-В излучение, являющееся наиболее энергоемким и травмирующим, поглощается молекулами, прежде все.го нуклеиновыми кислотами и белками. Абсорбция этой энергии способна приводить к прямым повреждениям как ДНК клеток (пиримидин-пиримидиновая и циклобутан-пиримидиновая димеризация), так и белковых молекул. Эти нарушения наиболее опасны в ростковом слое эпидермиса, где клетки митотически и метаболически активны. Как и все стресс-факторы, УФ-облучение приводит к стресс-индуцированному росту скорости клеточного деления [62, 63].
Запускаемая УФ-В лучами конверсия витамина D обеспечивает регуляцию (нормализацию) скорости деления клеток и «запрет» деления клеток с неисправленными повреждениями ДНК. Сохранение скорости деления — это мощная гарантия как последующей полноценной дифференцировки кератиноцитов, так и процесса кератинизации и формирования эпидермального барьера в целом [49, 50 ]. D-гормон [1,25(OH)2D] в кератиноцитах реализует действие белков теплового шока (heat shock proteins — HSP), а также процессы самодетоксикации и оптимизации энергетического обмена [62]. Это обеспечивает высокую стресс.выживаемость клеток и способность противостоять неблагоприятным факторам. В результате снижается не только количество «ожоговых» клеток (находящихся в режиме апоптоза), но и интенсивность сопутствующей им токсической/воспалительной реакции как в коже (локально), так и в организме (генерализованно). Этот эффект витамина D необходим для обновления эпидермиса, заживления кожных ран, поддержания барьерной функции кожи [51–54].
На настоящий момент существуют как экспериментальные, так и клинические работы, демонстрирующие мощный антипролиферативный эффект витамина D в кератиноцитах эпидермиса, что может обеспечивать за.щиту кожи от некоторых видов рака, в том числе и наиболее злокачественной формы — меланомы [55–61].
У 1,25(OH)2D выявлена также способность регулировать активность кателицидина — антимикробного белка, который является медиатором кожного врожденного иммунитета и способствует заживлению ран и репарации тканей [64, 65 ]. Активность этого белка проявляется уже на самых ранних стадиях нормального раневого процесса, и он способен модулировать воспаление в коже, индуцируя неоангиогенез и улучшая реэпителизацию (процесс восстановления эпидермального барьера, защищающего ростковые клетки от неблагоприятных воздействий), что подтверждает наличие у витамина D выраженных противовоспалительных и антибактериальных эффектов [66–70]. Усиление антибактериального компонента эффективно дополняется противовоспалительной стимуляцией — интенсивность иммунной межклеточной коммуникации снижается за счет подавления выработки провоспалителных иммунных цитокинов.
Витамин D в коже ускоряет обменные процессы и увеличивает сопротивляемость эпидермиса, нормализует содержание воды и управляет синтезом белка, являясь «дирижером» механизмов защиты кожи и запуска про.граммы восстановления нарушенных эпидермальных механизмов дифференцировки (кератинизации) [71, 72]. В целом можно отметить, что чем неблагоприятнее внешняя среда, интенсивнее внешнее воздействие на кожу или более выражен воспалительный процесс, тем выше потребность эпидермиса в собственном D-гормоне.
Как уже упоминалось ранее, с возрастом кожа постепенно теряет способность синтезировать D-гормон, что сопровождается одновременным снижением уровня провитамина D (7-DHC) и уменьшением количества рецепторов к нему в структурах кожного покрова. В результате естественная барьерная функция эпидермиса ухудшается, кожа становится сухой, безжизненной и дряблой. При этом снижается устойчивость кожи к внешним воз.действиям, в результате чего повышается частота фотоповреждений, приводящих к повреждению ДНК, ускорению апоптоза, нарушениям репарации, что неизбежно сопровождает процессы возрастного старения кожи и повышает риск развития кожных форм рака [73, 74].
Таким образом, витамин D — это эссенциальный фак.тор сохранения здоровья и молодости кожи, роль которого возрастает именно в стресс-условиях. Он органично удовлетворяет потребности кожи любого возраста (как здоровой, так и поврежденной) и обладает комплексным плейотропным anti-age действием. К сожалению, кожа не всегда может реализовать свой собственный потенциал активизации витамина D, тем более при старении организма. Поэтому с помощью косметических средств, содержащих этот витамин, можно эффективно поддерживать процессы метаболизма витамина D в коже. Это снижает зависимость кожи от общего дефицита витамина D в организме и тем самым локально противодействует старению самой кожи.
Применение витамина D в дерматокосметологии
Первые клинические работы по топическим формам витамина D относятся к 70–80 гг. XX в. и связаны с успешным лечением псориаза при применении активной формы витамина D (D-гормона). Так, Morimoto S. с соавт. (1986) сообщали о 5 случаях персистирующего псориаза, которые они успешно лечили местной формой 1,25(ОН)2D (кальцитриола) в концентрации 0,5 мкг/г в течение 2–5 нед без каких-либо местных или системных побочных явлений [75]. В 1991 г. топические препараты витамина D появились в Европе, ав 1994 г. местные формы D-гормона [1,25(ОН)2D] для лечения псориаза были впервые официально разрешены FDA в США [76].
В настоящее время существует огромное количество публикаций, посвященных топическому применению D-гормона (кальцитриола) и его активных синтетических аналогов (кальципотриола, такальцитола и максакальцитола) в дерматокосметологии, которые невозможно осветить в рамках данной статьи. Согласно данным нового систематического обзора 2014 г., основанного на анализе 165 научных публикаций, посвященных местному применению активных форм витамина D для лечения заболеваний кожи, на сегодняшний день можно дать рекомендации умеренно достоверного характера о том, что местное применение кальцитриола и его активных синтетических аналогов в комбинации с топическими кортикостероидами и фототерапией эффективно при лечении таких заболеваний, как витилиго и псориаз, а в качестве монотерапии — при лечении различных ихтиозов, редкого кожного заболевания очаговая склеродермия, отрубевидного лишая, почесухи узловатой, а также фотоповреждений кожи [77].
Сегодня в России, США, некоторых странах Европы и Азии зарегистрированы топические препараты кальцитриола и его синтетических аналогов (кальципотриола, такаль.цитола и максакальцитола) для лечения псориаза. Однако применение этих препаратов в косметических средствах крайне ограничено и даже запрещено в некоторых странах в связи со сложностью дозирования (даже при местном применении) и опасностью развития системных эффектов в виде гиперкальциемии и повышенной экскреции кальция почками, даже несмотря на хороший клинический эффект этих препаратов в отношении кожного воспаления и лечения гиперпролиферативных заболеваний кожи [78–80].
Вместо этого в косметических средствах используется его предшественник — провитамин D (7-DHC) растительного или животного происхождения, образующийся из стеринов под воздействием УФ-В лучей [81].
Как уже упоминалось в данной статье, с возрастом содержание 7-DHC в коже резко снижается, что не позволяет клеткам кожи срочно удовлетворить собственные потребности в D-гормоне, возрастающие на фоне неблагоприятного воздействия. В исследованиях in vitro и in vivo показано, что накожное нанесение 7-DHC запускает в коже механизмы, присущие активной форме витамина D [82].
7-DHC является жирорастворимым веществом с ограниченными технологическими возможностями. Точечный синтез циклодекстриновых молекулярных колец определенного диаметра позволяет плотно упаковывать 7-DHC внутрь молекулярного кольца, что делает его водорастворимым, более стабильным и технологичным [83].
Необычайно важно, что 7-DHC не обладает какой-либо собственной витаминной активностью и не вторгается в процессы жизнедеятельности клетки, но его наличие обеспечивает ей дополнительный запас прочности, формирует безопасное собственное провитаминное депо, которое не расходуется без необходимости. Активная форма витамина D синтезируется из провитамина только на основании сформированной биологической потребности, распознанной самой клеткой. В этом и есть основа безопасности и эффективности местного применения провитамина D.
Литература
1. Шварц Г.Я. Витамин D и D-гормон. М.: Анахарсис, 2005. 152 с.
2. Holick M.F., Binkley N.C., Bischoff-Ferrari H.A., et al. Endocrine So.ciety. Evaluation, treatment, and prevention of vitamin D deficiency: Аn Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2011; 96 (7): 1911–1930.
3. Holick M.F. Vitamin D deficiency. New Eng J Med 2007; 357: 266–281.
4. Kinuta K., Tanaka H., Moriwake T., Aya K., Kato S., Seino Y. Vitamin D is an important factor in estrogen biosynthesis of both female and male gonads. Endocrinol 2000; 141: 1317–1324.
5. Castro L.C. The vitamin D endocrine system. Arq Bras Endocrinol Me.tabol 2011; 55 (8): 566–575.
6. Jones G., Strugnell S.A., DeLuca H.F. Current understanding of the mo.lecular actions of vitamin D. Physiological Reviews 1998; 78: 1193–1231.
7. Jenster G., Spencer T.E., Burcin M.M., Tsai S.Y., Tsai M.J., O’Malley B.W. Steroid receptor induction of gene transcription: А two-step model. PNAS 1997; 94: 7879–7884.
8. Bouillon R., Carmeliet G., Verlinden L., van Etten E., Verstuyf A., Luderer H.F., Lieben L., Mathieu C., Demay M. Vitamin D and hu.man health: Lessons from vitamin D receptor null mice. Endocrine Reviews 2008; 29: 720–726.
9. Blomberg J.M., Dissing S. Non-genomic effects of vitamin D in human spermatozoa. Steroids 2012; 77 (10): 903–909.
10. Rojansky N., Brzezinski A., Schenker J.G. Seasonality in human repro.duction: Аn update. Human Reproduction 1992; 7: 735–745.
11. Palacios С., Gonzalez L. Is vitamin D deficiency a major global public health problem? J Steroid Biochem Mol Biol 2014; 144 Pt A: 138–145.
12. Тишова Ю.А., Ворслов Л.О., Жуков А.Ю., Калинченко С.Ю. Распро.страненность дефицита D-гормона (25ОНD3) у пациентов с ожи.рением в России: ретроспективное популяционное исследование. Материалы VII Международного конгресса ISSAM. М., 2013; 78–79.
13. Тюзиков И.А. Гормон D-статус у мужчин с андрологической пато.логией (пилотное исследование). Материалы X Международно.го конгресса «Мужское здоровье». Минск, 2014; 89–91.
14. Плещева А.В., Пигарова Е.А., Дзеранова Л.К. Витамин D и мета.болизм: факты, мифы и предубеждения. Ожирение и метабо.лизм 2012; 2: 33–42.
15. Ford J.A., MacLennan G.S., Avenell A., Bolland M., Grey A., Witham M. RECORD Trial Group. Cardiovascular disease and vitamin D supple.mentation: Тrial analysis, systematic review, and meta-analysis. Am J Clin Nutr 2014; 100 (3): 746–755.
16. Wehr E., Pilz S., Schweighofer N., et al. Association of hypovitamino.sis D with metabolic disturbances in polycystic ovary syndrome. Eur. J. Endocrinol 2009; 161: 575–582.
17. Zittermann A., Prokop S. The role of vitamin D for cardiovascular dis.ease and overall mortality. Adv Exp Med Biol 2014; 810: 106–119.
18. Tomlinson P.B., Joseph C., Angioi M.. Effects of vitamin D supplemen.tation on upper and lower body muscle strength levels in healthy in.dividuals. A systematic review with meta-analysis. J Sci Med Sport 2014 Aug 11; pii: S1440-2440(14)00163-7.
19. Haghsheno M.A., Mellstr.m D., Behre C.J., et al. Low 25-OH vitamin D is associated with benign prostatic hyperplasia. J Urol 2013; 190 (2): 608–614.
20. Gandini S., Boniol M., Haukka J., et al. Meta-analysis of observational studies of serum 25-hydroxyvitamin D levels and colorectal, breast and prostate cancer and colorectal adenoma. Int J Cancer 2011; 128 (6): 1414–1424.
21. Xu Y., Shao X., Yao Y., et al. Positive association between circulat.ing 25-hydroxyvitamin D levels and prostate cancer risk: new findings from an updated meta-analysis. J Cancer Res Clin Oncol 2014; 140 (9): 1465–1477.
22. Meyer H.E., Robsahm T.E., Bj.rge T., et al. Vitamin D, season, and risk of prostate cancer: А nested case-control study within Norwegian health studies. Am J Clin Nutr 2013; 97 (1): 147–154.
23. Xu Y., He B., Pan Y., et al. Systematic review and meta-analysis on vitamin D receptor polymorphisms and cancer risk. Tumour Biol 2014; 35 (5): 4153–4169.
24. Bischoff-Ferrari H.A., Giovannucci E., Willett W.C., Dietrich T., Dawson-Hughes B. Estimation of optimal serum concentrations of 25-hydroxyvi.tamin D for multiple health outcomes. Am J Clin Nutr 2006; 84 (1): 18–28.
25. Pludowski P., Holick M.F., Pilz S., Wagner C.L., Hollis B.W., Grant W.B., Shoenfeld Y., Lerchbaum E., Llewellyn D.J., Kienreich K., Soni M. Vitamin D effects on musculoskeletal health, immunity, autoimmunity, cardio.vascular disease, cancer, fertility, pregnancy, dementia and mortality — a review of recent evidence. Autoimmun Rev 2013; 12 (10): 976–989.
26. The Vitamin D Society. http://vitamindsociety.org/benefits.php.
27. Калинченко С.Ю., Тюзиков И.А., Гусакова Д.А., Ворслов Л.О., Ти.шова Ю.А., Греков Е.А., Фомин А.М. Витамин D как новый стеро.идный гормон и его значение для мужского здоровья. Эффек.тивная фармакотерапия. Урология и нефрология 2015; 27: 38–47.
28. Калинченко С.Ю., Тишова Ю.А., Тюзиков И.А., Ворслов Л.О. Ожи.рение и метаболический синдром у мужчин. М., 2014.
29. Derakhshanian H., Shab-Bidar S., Speakman J.R., Nadimi H., Djafarian K. Vitamin D and diabetic nephropathy: A systematic review and me.ta-analysis. Nutrition 2015 May 9; pii: S0899-9007(15)00174-4.
30. Mehrotra A., Leung W.Y., Joson T. Nutritional vitamin D supplemen.tation and health-related outcomes in hemodialysis patients: А pro.tocol for a systematic review and meta-analysis. Syst Rev 2015; 4: 106.
31. Shen L., Ji H.F. Vitamin D deficiency is associated with increased risk of Alzheimer’s disease and dementia: Еvidence from meta-analysis. Nutr J 2015; 14 (1): 76.
32. Stokes C.S., Gr.nhage F., Baus C., Volmer D.A., Wagenpfeil S., Rie.menschneider M., Lammert F. Vitamin D supplementation reduces depressive symptoms in patients with chronic liver disease. Clin Nutr 2015 Jul 16; pii: S0261-5614(15)00178–8.
33. Shen L., Ji H.F. Associations between vitamin D status, supplemen.tation, outdoor work and risk of parkinson’s disease: A meta-analy.sis assessment. Nutrients 2015; 7 (6): 4817–4827.
34. Zhang L., Wang S., Che X., Li X. Vitamin D and lung cancer risk: A comprehensive review and meta-analysis. Cell Physiol Biochem 2015; 36 (1): 299–305.
35. Shanmugalingam T., Crawley D., Bosco C., Melvin J., Rohrmann S., Chowdhury S., Holmberg L., Van Hemelrijck M. Obesity and cancer: The role of vitamin D. BMC Cancer 2014; 14: 712.
36. Schwingshackl L., Hoffmann G., Buijsse B., Mittag T., Stelmach-Mardas M., Boeing H., Gottschald M., Dietrich S., Arregui M., Dias S. Dietary supplements and risk of cause-specific death, cardiovascu.lar disease, and cancer: A protocol for a systematic review and net.work meta-analysis of primary prevention trials. Syst Rev 2015; 4: 34.
37. Parker J., Hashmi O., Dutton D., Mavrodaris A. Levels of vitamin D and cardiometabolic disorders: A systematic review and meta-analy.sis. Maturitas 2010; 65 (3): 225–236.
38. Forouhi N.G., Ye Z. Circulating 25-hydroxyvitamin D concentration and the risk of type 2 diabetes: results from the European Prospective Investigation into Cancer (EPIC)-Norfolk cohort and updated meta.analysis of prospective studies. Diabetologia 2012; 55 (8): 2173–2182.
39. Song Y., Wang L., Pittas A.G. Blood 25-hydroxy vitamin D levels and incident type 2 diabetes: A meta-analysis of prospective studies. Dia.betes Care 2013; 36 (5): 1422–1428.
40. Ju S.Y., Jeong H.S., Kim do H. Blood vitamin D status and metabolic syndrome in the general adult population: a dose-response meta.analysis. J Clin Endocrinol Metab 2014; 99 (3): 1053–1063.
41. Khan H., Kunutsor S. Vitamin D, type 2 diabetes and other metabolic outcomes: A systematic review and meta-analysis of prospective studies. Proc Nutr Soc 2013; 72 (1): 89–97.
42. Holick M.F. Resurrection of vitamin D deficiency and rickets. J Clin Invest 2006; 116 (8): 2062–2072.
43. Brunette M.G., Chan M., Ferriere C., Roberts K.D. Site of 1,25(OH)2 vitamin D3 synthesis in the kidney. Nature 1978; 276 (5685): 287–289.
44. Bikle D.D., Nemanic M.K., Gee E., Elias P. 1,25-Dihydroxyvitamin D3 production by human keratinocytes. Kinetics and regulation. J Clin Invest 1986; 78 (2): 557–566.
45. Bikle D.D., Nemanic M.K., Whitney J.O., Elias P.W. Neonatal human foreskin keratinocytes produce 1,25-dihydroxyvitamin D3. Biochemis.try 1986; 25 (7): 1545–1548.
46. Lehmann B., Sauter W., Knuschke P., Dressler S., Meurer M. Demonstra.tion of UVB-induced synthesis of 1 alpha,25-dihydroxyvitamin D3 (calcitri.ol) in human skin by microdialysis. Arch Dermatol Res 2003; 295 (1): 24–28.
47. Holick M.F., MacLaughlin J.A., Clark M.B., et al. Photosynthesis of pre.vitamin D3 in human skin and the physiologic consequences. Science 1980; 210 (4466): 203–205.
48. Holick M.F., MacLaughlin J.A., Doppelt S.H. Regulation of cutaneous previtamin D3 photosynthesis in man: skin pigment is not an essen.tial regulator. Science 1981; 211 (4482): 590–593.
49. Skorija K., Cox M., Sisk J.M., et al. Ligand-independent actions of the vitamin D receptor maintain hair follicle homeostasis. Mol Endocrinol 2005; 19 (4): 855–862.
50. Sakai Y., Demay M.B. Evaluation of keratinocyte proliferation and dif.ferentiation in vitamin D receptor knockout mice. Endocrinol 2000; 141 (6): 2043–2049.
51. MacLaughlin J., Holick M.F. Aging decreases the capacity of human skin to produce vitamin D3. J Clin Invest 1985; 76 (4): 1536–1538.
52. Jones G., Strugnell S.A., DeLuca H.F. Current understanding of the molecular actions of vitamin D. Physiol Rev 1998; 78 (4): 1193–1231.
53. Jurutka P.W., Whitfield G.K., Hsieh J.C., Thompson P.D., Haussler C.A., Haussler M.R. Molecular nature of the vitamin D receptor and its role in regulation of gene expression. Rev Endocr Metab Disord 2001; 2 (2): 203–216.
54. Yuan F.N., Valiyaparambil J., Woods M.C., Tran H., Pant R., Adams J.S., Mallya S.M. Vitamin D signaling regulates oral keratinocyte prolifera.tion in vitro and in vivo. Int J Oncol 2014; 44 (5): 1625–1633.
55. Field S., Davies J., Bishop D.T., Newton-Bishop J.A. Vitamin D and melanoma. Dermatoendocrinol 2013; 5 (1): 121–129.
56. Tongkao-On W., Gordon-Thomson C., Dixon K.M., Song E.J., Luu T., Car ter S.E., Sequeira V.B., Reeve V.E., Mason R.S. Novel vitamin D com.pounds and skin cancer prevention. Dermatoendocrinol 2013; 5 (1): 20–33.
57. Odland G.F. Structure of the skin. In: Goldsmith LA, ed. Physiology, biochemistry, and molecular biology of the skin. 2nd ed. New York: Oxford University Press 1991: 3–62.
58. Freinkel R.K., Woodley D. The biology of the skin. New York: Parthe.non Pub. Group 2001.
59. Bikle D.D. Vitamin D metabolism and function in the skin. Mol Cell Endocrinol 2011; 347 (1–2): 80–89.
60. Bikle D.D., Pillai S. Vitamin D, calcium, and epidermal differentiation. Endocr Rev 1993; 14 (1): 3–19.
61. Suaini N.H., Zhang Y., Vuillermin P.J., Allen K.J., Harrison L.C. Immune modulation by vitamin D and its relevance to food allergy. Nutrients 2015; 7 (8): 6088–6108.
62. Kannan S., Lim H.W. Photoprotection and vitamin D: A review. Photo.dermatol Photoimmunol Photomed 2014; 30 (2–3): 137–145.
63. Lee J., Youn J.I. The photoprotective effect of 1,25-dihydroxyvitamin D3 on ultraviolet light B-induced damage in keratinocyte and its mechanism of action. J Dermatol Sci 1998; 18 (1): 11–18.
64. Wang T.T., Nestel F.P., Bourdeau V., et al. Cutting edge: 1,25-dihy.droxyvitamin D3 is a direct inducer of antimicrobial peptide gene ex.pression. J Immunol 2004; 173 (5): 2909–2912.
65. Gombart A.F., Borregaard N., Koeffler H.P. Human cathelicidin an.timicrobial peptide (CAMP) gene is a direct target of the vitamin D receptor and is strongly up-regulated in myeloid cells by 1,25-dihy.droxyvitamin D3. Faseb J 2005; 19 (9): 1067–1077.
66. Heilborn J.D., Nilsson M.F., Kratz G., et al. The cathelicidin anti-mi.crobial peptide LL-37 is involved in re-epithelialization of human skin wounds and is lacking in chronic ulcer epithelium. J Invest Dermatol 2003; 120 (3): 379–389.
67. Frohm M., Agerberth B., Ahangari G., et al. The expression of the gene coding for the antibacterial peptide LL-37 is induced in human kera.tinocytes during inflammatory disorders. J Biol Chem 1997; 272 (24): 15258–15263.
68. Koczulla R., von Degenfeld G., Kupatt C., et al. An angiogenic role for the human peptide antibiotic LL-37/hCAP-18. J Clin Invest 2003; 111 (11): 1665–1672.
69. Weber G., Heilborn J.D., Chamorro Jimenez C.I., Hammarsjo A., Tor.ma H., Stahle M. Vitamin D induces the antimicrobial protein hCAP18 in human skin. J Invest Dermatol 2005; 124 (5): 1080–1082.
70. Wang T.T., Nestel F.P., Bourdeau V., et al. Cutting edge: 1,25-dihy.droxyvitamin D3 is a direct inducer of antimicrobial peptide gene expression. J Immunol 2004; 173 (5): 2909–2912.
71. Jeong M.S., Kim J.-Y., Lee H.I., Seo S.J. Calcitriol may down-regulate mRNA over-expression of toll-like receptor-2 and -4, LL-37 and proin.flammatory cytokines in cultured human keratinocytes. Ann Derma.tol 2014; Vol. 26; 296–302.
72. Libon F., Cavalier E., Nikkels A.F. Vitamin D and the skin. Rev Med Liege 2013; 68 (9): 458–464.
73. Burns E.M., Elmets C.A., Yusuf N. Vitamin D and skin cancer. Photo.chem Photobiol 2015; 91 (1): 201–209.
74. Khavkin J., Ellis D.A. Aging skin: Histology, physiology, and pathology. Facial Plast Surg Clin North Am 2011; 19 (2): 229–234.
75. Morimoto S., Onishi T., Imanaka S., et al. Topical administration of 1,25-dihydroxyvitamin D3 for psoriasis: Report of five cases. Calcif Tis.sue Int 1986; 38 (2): 119–122.
76. Ashcroft D.M., Po A.L., Williams H.C., Griffiths C.E. A systematic re.view of comparative efficacy and tolerability of calcipotriol in treat.ing chronic plaque psoriasis BMJ 2000; 320: 963–967.
77. Wat H., Dytoc M. Off-label uses of topical vitamin D in dermatol.ogy: A systematic review. J. Cutaneous Medic. Surgery 2014; Vol 18; 2: 91–108.
78. MacLaughlin J.A., Cantley L.C., Holick M.F. 1,25-(OH)2 D3 increase cal.cium and phosphatidylinositol metabolism in differentiating cultured human keratinocytes. J Nutr Biochem 1990; 1: 81–87.
79. Yada Y., Ozeki T., Meguro S. Signal transduction in the onset of termi.nal keratinocyte differenciation induced by 1a,25-(OH) 2-vitamin D3: Role of protein kinase C translocation. Biochem Biophys Res Com.mun 1989; 163: 1517–1522.
80. Iwakura T., Ohashi N., Tsuji N., Naito Y., et al. Calcitriol-induced hy.percalcemia in a patient with granulomatous mycosis fungoides and end-stage renal disease. World J Nephrol 2013; 2 (2): 44–48.
81. J.pelt R.B., Jakobsen J. Vitamin D in plants: a review of occurrence, analysis, and biosynthesis. Front Plant Sci 2013; 4: 136.
82. Mammone T. et al. Normal human epidermal keratinocytes treated with 7-dehydrocholesterol express increased levels of heat shock protein. J. Cosm. Sci 2004; 55: 149–155.
83. Прокопов А. Витамин D: «ренессанс» в косметологии. Les Nou.velles Esthetiques 2015; 5: 2–12.
ЧИТАЙТЕ ТАКЖЕ