Мелатонин для профилактики и лечения рака
Аннотация
Эпидемиологические исследования показали возможное онкостатическое свойство мелатонина при различных типах опухолей. Кроме того, экспериментальные исследования задокументировали, что мелатонин может оказывать ингибирующее действие на некоторые опухолевые клетки человека in vitro и на животных моделях.
Основные механизмы включают антиоксидантную активность, модуляцию мелатониновых рецепторов MT1 и MT2, стимуляцию апоптоза, регуляцию сигналов, способствующих выживанию, и метаболизма опухоли, ингибирование ангиогенеза, метастазирования и индукцию эпигенетических изменений.
Мелатонин также может быть использован в качестве вспомогательного средства при лечении рака, усиливая терапевтический эффект и уменьшая побочные эффекты химиотерапии или облучения.
Мелатонин может быть отличным кандидатом для профилактики и лечения нескольких видов рака, таких как рак молочной железы, рак предстательной железы, рак желудка и колоректальный рак.
В этом обзоре обобщена противоопухолевая эффективность мелатонина, основанная на результатах эпидемиологических, экспериментальных и клинических исследований, при этом особое внимание было уделено механизмам действия.
Ключевые слова: мелатонин, противоопухолевое средство, механизмы действия, рецептор, апоптоз
Введение
Мелатонин (N-ацетил-5-метокситриптамин, рисунок 1) представляет собой индольное соединение, выделяемое главным образом шишковидной железой человека и млекопитающих в ответ на темноту [1].
Кроме шишковидной железы, синтез мелатонина также обнаруживается в ряде других органов, включая сетчатку, желудочно-кишечный тракт, кожу, костный мозг и лимфоциты [2].
Процесс биосинтеза и метаболизма мелатонина показан на рисунке 2, и в него включен только основной метаболит 6-сульфатоксимелатонин (aMT6s), поскольку он обычно используется в качестве источника циркадного уровня мелатонина [3–5].
Синтез и секреция мелатонина регулируются "главными биологическими часами", расположенными в супрахиазматическом ядре (SCN) гипоталамуса [6]. Хотя мелатонин регулируется центральными циркадными часами, он также может модулировать центральные циркадные часы и периферические осцилляторы в тканях и органах, что делает мелатонин маркером циркадных ритмов [7].
Уровень мелатонина повышается ночью и снижается в течение дня. Исследования показали, что повышенный уровень мелатонина в крови в ночное время может посылать сигналы клеткам и органам организма о том, что сейчас ночное время, и помогать органам-мишеням и системам органов настраиваться на соответствующие гомеостатические метаболические ритмы [8].
Следовательно, свет ночью может нарушать циркадный ритм и выработку мелатонина [9], что может способствовать развитию, промотированию и прогрессированию раковых заболеваний.
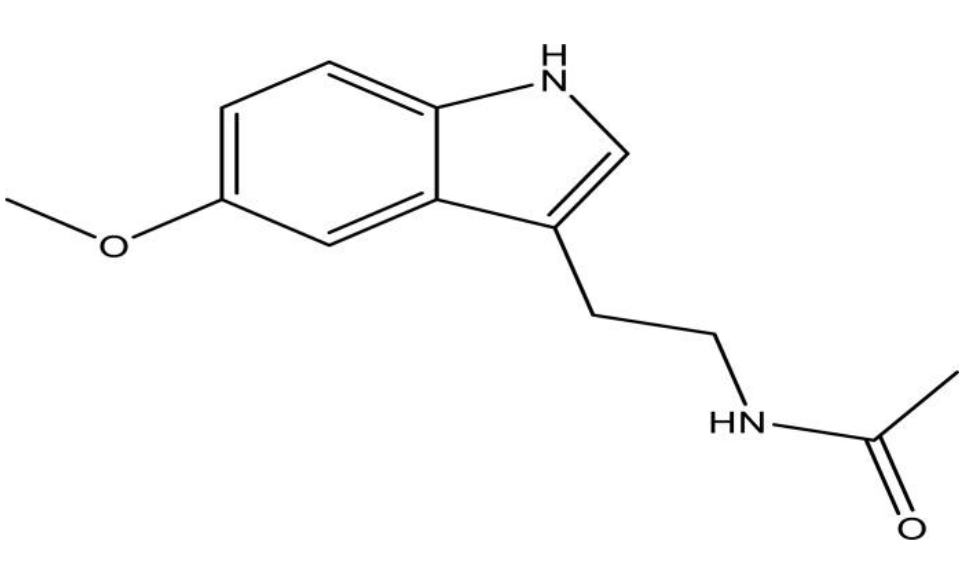 Рисунок 1. Структура мелатонина
Рисунок 1. Структура мелатонина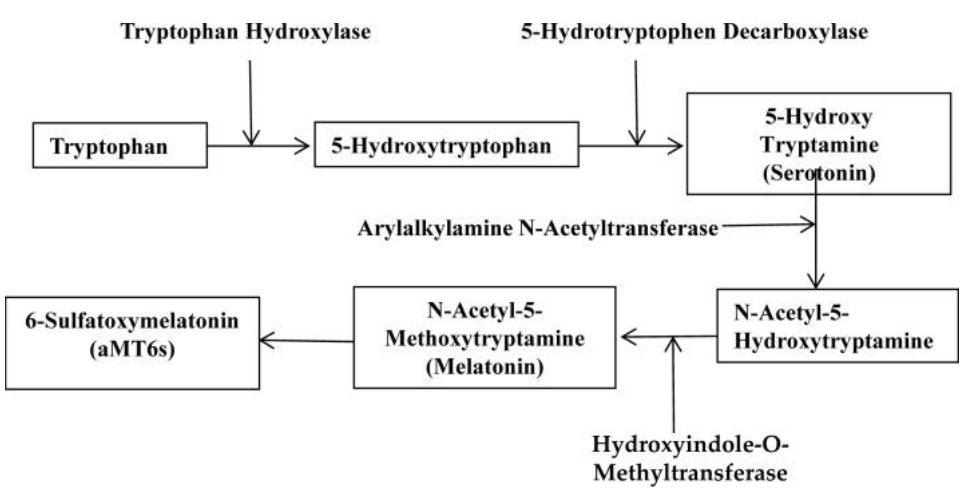 Рисунок 2. Процесс биосинтеза и метаболизма мелатонина
Рисунок 2. Процесс биосинтеза и метаболизма мелатонинаСогласно данным, представленным ВОЗ, рак является ведущей причиной заболеваемости и смертности во всем мире: в 2012 году было зарегистрировано примерно 14 миллионов новых случаев и 8,2 миллиона смертей, связанных с раком [10]. По оценкам, только в США в 2016 году может произойти 1 685 210 новых случаев рака и 595 690 смертей от рака [11]. В настоящее время пациенты с раком в основном рассчитывают на клиническое лечение, например, хирургическое вмешательство, лучевую терапию и химиотерапию. Кроме того, некоторые натуральные продукты показали потенциал для профилактики и лечения раковых заболеваний [12–21]. Исследования по раку и противоопухолевой терапии привлекли большое внимание.
В последние десятилетия накапливающиеся данные показали актуальность мелатонина для физиологии и патологии человека. В настоящее время общепризнано, что мелатонин является не только гормоном, но и защитником клеток [22], участвующим в иммуномодуляции, антиоксидантных процессах и кроветворении [23, 24].
Более того, ряд исследований показали, что мелатонин обладает важными онкостатическими свойствами благодаря рецепторзависимым и рецепторнезависимым механизмам [25].
Рецепторы мелатонина MT1 (кодируемые MTNR1A) и MT2 (кодируемые MTNR1B) принадлежат к группе рецепторов, связанных с G-белком (GPCR) [26], и в основном отвечают за опосредование последующих эффектов мелатонина [27].
Что касается заболеваемости, то они участвуют в ингибировании аденилциклазы и циклического АМФ (цАМФ), что приводит к снижению поглощения линолевой кислоты. Индуцированное мелатонином ингибирование поглощения линолевой кислоты рассматривается как механизм ее антипролиферативных эффектов [28].
Рецепторно-независимые механизмы связаны с антиоксидантной активностью, регуляцией апоптоза, метаболизма опухоли и иммунитета к раку, ингибированием ангиогенеза и миграции и предотвращением нарушения циркадного ритма [25, 29, 30].
Мелатонин также продемонстрировал потенциал для использования в качестве вспомогательного средства при лечении рака, усиливая терапевтический эффект и уменьшая побочные эффекты химиотерапии или облучения [31].
Целью настоящего обзора является обобщение недавних открытий в отношении онкостатических свойств мелатонина, классифицируемых по гормонозависимым видам рака и гормонально-независимым видам рака, и обсуждение механизмов действия на основе результатов эпидемиологических исследований, экспериментальных исследований и клинических испытаний.
ЭПИДЕМИОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ
Несколько эпидемиологических исследований подтверждают защитную роль мелатонина при раке, однако не все эпидемиологические исследования согласуются (таблица 1). Некоторые исследования показали обратную связь между циркадным уровнем мелатонина и заболеваемостью раком молочной железы.
Согласно анализу "доза-эффект" обсервационных исследований, высокое воздействие искусственной локальной сети было связано с повышенным риском рака молочной железы (ОР = 1,17, 95% ДИ: 1,11-1,23), а риск рака молочной железы был снижен на 14% при увеличении содержания 15 нг/мг креатинина в aMT6s мочи (ОР = 0,86, 95% ДИ: 0,78-0,95) с линейной тенденцией "доза-эффект" (Р-тренд = 0,003) [32].
Кроме того, исследование "случай-контроль" показало, что женщины с уровнем мелатонина в сыворотке крови ≤ 39,5 пг / мл имели значительно более высокий риск заболеваемости раком молочной железы (примерно в 15 раз) по сравнению с пациентками с уровнем > 39,5 пг / мл (OR = 14,24; 95% ДИ = 4,32-46,90).
Между тем, генотип GG полиморфизма rs#10830963 гена MTNR1b (кодирующего мелатониновый рецептор MT2) rs#10830963 значительно повышал риск рака молочной железы примерно в 21 раз больше, чем генотип CC (OR = 20,67; 95% ДИ = 4,77-99,33) [33].
Кроме того, метаанализ, включающий 5 проспективных исследований типа "случай-контроль", сообщил об обратной зависимости между риском развития рака молочной железы и самыми высокими уровнями AMT6 в моче [34].
В другом исследовании оценивалась связь между риском развития рака молочной железы и распространенными однонуклеотидными полиморфизмами в генах MTNR1a, MTNR1b и AANAT (кодирующей арилалкиламин N-ацетилтрансферазы) среди 2073 случаев и 2083 контрольных групп.
Также сообщалось, что распространенные генетические вариации в генах MTNR1a и MTNR1b могут способствовать восприимчивости к раку молочной железы, и ассоциации могут варьироваться в зависимости от менопаузального статуса [27].
Во вложенном исследовании "случай-контроль" сообщалось, что более высокий уровень aMT6s в моче был достоверно связан с более низким риском рака молочной железы (OR = 0,62; 95% ДИ 0,41-0,95; P (тренд) = 0,004) [35].
Тем не менее, 4 исследования "случай-контроль" показали, что не было доказательств того, что уровень мелатонина был связан с риском развития рака молочной железы.
Проспективное вложенное исследование типа "случай-контроль" среди британских женщин показало, что статистически значимых различий в уровне aMT6s в моче между женщинами с раком молочной железы и здоровыми женщинами не наблюдалось, независимо от менопаузального статуса [36].
Кроме того, исследование "случай-контроль", включенное в наблюдательную группу Инициативы по охране здоровья женщин, сообщило, что не было доказательств того, что более высокие уровни мелатонина в моче были обратно пропорционально связаны с риском развития рака молочной железы у женщин в постменопаузе [37].
Результаты другого исследования "случай-контроль", включенного в когорту II исследования здоровья медсестер, также не подтвердили общую связь между уровнями мелатонина в моче и риском развития рака молочной железы [38].
Аналогичным образом, не было обнаружено значимой связи между уровнем aMT6s и риском развития рака молочной железы (ни в целом, ни в зависимости от менопаузального статуса) в исследовании "случай-контроль", включенном в исследование Guernsey III [39].
 Таблица 1. Эпидемиологические исследования уровня мелатонина и рисков развития рака
Таблица 1. Эпидемиологические исследования уровня мелатонина и рисков развития ракаЧто касается других видов рака, кроме рака молочной железы, то в исследовании case-cohort сообщалось, что мужчины с уровнем aMT6s в моче в первое утро ниже медианы имели в четыре раза более высокий риск развития рака предстательной железы по сравнению с мужчинами с уровнем выше медианы (ОР: 4,04; 95% ДИ: 1,26-12,98) [40].
Исследование "случай-контроль" показало, что пациенты с высоким уровнем мелатонин-сульфата или высоким соотношением мелатонин-сульфат / кортизол имели меньшую вероятность заболеть раком предстательной железы (скорректированный OR (aOR) = 0,59, 95% ДИ: 0,35-0,99; aOR = 0,46, 95% ДИ: 0,27-0,77) или запущенной стадией простаты (aOR = 0,49, 95% ДИ = 0,26-0,89; aOR = 0,33, 95% ДИ = 0,17 -0,62) [41].
Ретроспективное исследование показало, что уровни мелатонина в сыворотке крови у женщин с раком яичников были значительно ниже по сравнению с контрольными субъектами (p < 0,05), что указывает на то, что снижение уровня циркулирующего мелатонина может способствовать патогенезу рака яичников [42].
Согласно метаанализу РКИ, мелатонин значительно улучшал полную и частичную ремиссию (16,5 против 32,6%; ОР = 1,95, 95% ДИ: 1,49-2,54; р < 0,00001), годичную выживаемость (28,4 против 52,2%; ОР = 1,90; 95% ДИ: 1,28-2,83; р = 0.001) при солидных опухолях и заметно уменьшил побочные эффекты, вызванные радиохимиотерапией, включая нейротоксичность, тромбоцитопению и усталость.
Эффекты были одинаковыми при различных типах рака [43]. Другой метаанализ, обобщающий 21 клиническое исследование, все из которых касались солидных опухолей, показал, что мелатонин в качестве адъюванта к химиотерапии при лечении рака снижал годичную смертность (ОР = 0,60; 95% ДИ: 0,54-0,67) и уменьшал вызванные химиотерапией симптомы, такие как астения, лейкопения, тошнота, рвота и гипотензия [44].
Однако вложенное исследование "случай-контроль" показало, что не наблюдалось очевидной связи между уровнем мелатонина в моче и риском развития рака яичников [45].
Следует отметить, что в существующих эпидемиологических исследованиях методы оценки уровня мелатонина не являются единообразными, поскольку концентрации мелатонина измерялись в разных образцах, таких как моча, плазма или сыворотка.
Более того, концентрация мелатонина в организме человека изменяется в зависимости от циркадного ритма, однако не было определено, какое время взятия пробы могло бы наилучшим образом отразить биологические эффекты мелатонина.
Эти различия могут частично привести к несоответствию эпидемиологических исследований. В этом случае лабораторное исследование в культуре клеток или на животных моделях могло бы быть более четким и прямым для оценки противоопухолевого эффекта мелатонина и изучения возможных механизмов, участвующих в этом процессе.
ЭКСПЕРИМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ
Накопленные данные экспериментальных исследований подтверждают противоопухолевые свойства мелатонина. Учитывая огромное количество исследований, был проведен поиск публикаций в базах данных PubMed и Web of Science и были выявлены соответствующие рецензируемые статьи, опубликованные на английском языке в течение 5 лет.
Гормонозависимый рак
Рак молочной железы
Рак молочной железы является одним из наиболее распространенных видов рака у женщин и одной из ведущих причин смерти женщин в возрасте от 40 до 55 лет [46]. Исследования, касающиеся воздействия мелатонина на рак молочной железы, являются крупнейшими, возможно, из-за того, что мелатонин, как было показано, модулирует несколько аспектов эндокринной физиологии.
В ранних исследованиях сообщалось, что мелатонин оказывал антипролиферативное действие на клетки рака молочной железы in vitro [47] и ингибировал рост опухолей молочной железы у крыс [48, 49].
Впоследствии были последовательно идентифицированы различные механизмы противоопухолевых эффектов мелатонина, такие как индуцирование апоптоза [50], антиэстрогенный эффект через ERa-сигнальный путь и ингибирование активности ароматазы [51–53], модуляция рецепторов мелатонина [54] и ингибирование инвазии [55] и ангиогенеза [56].
Исследования in vitro
Мелатонин оказывал противометастатическое действие на клеточные линии рака молочной железы CMT-U229 и MCF-7, подавляя жизнеспособность и инвазивность маммосфер рака молочной железы, а также опосредуя экспрессию белков, связанных с эпителиально-мезенхимальным переходом (EMT) [57].
Противоинвазивный эффект мелатонина при раке молочной железы проявлялся также за счет подавления пути p38 и экспрессии и активности MMP-2 и -9 [58]. Мелатонин также снижал пролиферацию и жизнеспособность и индуцировал апоптоз в неопластических клетках молочной железы с лучшей эффективностью в ER-позитивных опухолях, которые демонстрировали высокую экспрессию мелатонинового рецептора MT1 [59].
Кроме того, мелатонин проявлял антипролиферативную активность и стимулировал апоптоз в клетках рака молочной железы MDA-MB-361 посредством одновременной модуляции передачи сигналов COX-2/PGE2, p300/NF-κB и PI3K/Akt/ и активации Apaf-1/каспазозависимого пути апоптоза [60].
Было продемонстрировано, что мелатонин может контролировать рост опухоли у пациентов с запущенным раком, что, по крайней мере частично, обусловлено функционированием в качестве естественной антиангиогенной молекулы, о чем свидетельствует снижение уровня VEGF в крови [61].
При раке молочной железы 1 нМ мелатонина снижал жизнеспособность гипоксических клеток рака молочной железы человека MCF-7 и MDA-MB-231 и снижал экспрессию генов и белков HIF-1α и VEGF-A (p < 0,05), что указывает на эффект антиангиогенеза [56].
Кроме того, Альварес-Гарсия и соавт. сообщалось об антиангиогенном эффекте мелатонина путем снижения экспрессии VEGF в клетках рака молочной железы человека, что снижало уровни VEGF вокруг эндотелиальных клеток [62]. В другом исследовании также было отмечено, что мелатонин эффективен в контроле ангиогенеза опухоли [63].
Мелатонин может ингибировать активность ароматазы в клетках рака молочной железы. Мелатонин в дозе 20 нМ вызывал антиароматазный эффект, столь же мощный, как 20 нМ летрозола, который является селективным модулятором фермента эстрогена и клинически используемым антиароматазным препаратом при лечении рака молочной железы [64].
Возможный механизм антиароматазного действия мелатонина заключался в ингибировании активности и экспрессии ЦОГ [65]. Аналогичным образом, лечение мелатонином оказывало значительное ингибирование транскрипции гена CYP19A1 и активности ароматазы в жировых фибробластах молочной железы и фибробластах, ассоциированных с раком молочной железы [66].
Кроме того, мелатонин может влиять на десмопластическую реакцию при раке молочной железы, посредством подавления экспрессии антиадипогенных цитокинов, которые могут способствовать дифференцировке фибробластов и оказывать антиароматазное действие, тем самым уменьшая количество продуцирующих эстроген клеток, расположенных вблизи злокачественных клеток [67].
Группа сообщила, что мелатонин может индуцировать дифференциальную экспрессию микроРНК и связанных с микроРНК генов в клетках рака молочной железы человека, что указывает на онкостатический эффект [68, 69].
Они сообщили, что лечение мелатонином проявляло противоопухолевый эффект за счет влияния на паттерны метилирования ДНК посредством подавления онкогенных генов (EGR3 и POU4F2/Brn-3b) и усиления регуляции гена-супрессора опухоли (GPC3) [70].
Длительное лечение мелатонином может частично подавлять пролиферацию и миграцию клеток рака молочной железы за счет снижения регуляции miR-24, который рассматривался как потенциальный диагностический опухолевый маркер [71].
Обработка МТ1-трансфицированных клеток MCF-7 мелатонином могла привести к значительному усилению ингибирования роста, в то время как МТ1-трансфицированные клетки MDA-MB-231 не проявляли ответа на мелатонин, что указывает на посредническую роль рецептора MT1 в онкостатической активности мелатонина [72].
Среди 3 ER-негативных клеточных линий рака молочной железы мелатонин ингибировал только пролиферацию клеток SK-BR-3, несмотря на то, что рецептор MT1 экспрессировался во всех трех клеточных линиях [73].
Заслуживает внимания также синергетический эффект мелатонина с другими противоопухолевыми препаратами или лучевой терапией. Мелатонин усиливал эффекты доксорубицина, активируя транзиторный потенциал рецептора vanilloid 1 (TRPV1) и апоптоз, а также индуцируя гибель клеток MCF-7 [74].
Мелатонин усиливал апоптотическую гибель клеток, индуцируемую триоксидом мышьяка, посредством генерации АФК, усиления экспрессии Redd1 и активации путей p38/JNK в клетках рака молочной железы человека [75].
Мелатонин (3 мм) в сочетании с пуромицином (1 мкм) оказывал синергическое ингибирующее действие на клетки MDA-MB 231 посредством ослабления экспрессии 45S пре-рРНК и вышестоящего фактора связывания, а также подавления вышестоящего фактора связывания XPO1 и IPO7, прокаспазы 3 и Bcl-xL [76].
Комбинированное лечение мелатонином с полностью транс-ретиноевой кислотой и соматостатином усиливало ингибирующий эффект на жизнеспособность и рост клеток MCF-7 [77].
Мелатонин в сочетании с витамином D3 синергически ингибировал пролиферацию с почти полной остановкой клеточного роста в клетках MCF-7 [78]. Мелатонин также может повышать радиочувствительность раковых клеток.
Предварительная обработка мелатонином клеток рака молочной железы MCF-7 за 1 неделю до облучения может повысить чувствительность раковых клеток к ионизирующему воздействию радиации путем ингибирования пролиферации, способствуя остановке клеточного цикла и ингибируя белки, участвующие в репарации двухцепочечных разрывов ДНК [79].
Другое исследование показало, что усиливающий эффект мелатонина на радиочувствительность клеток рака молочной железы человека может быть связан с увеличением экспрессии р53 [80].
Исследования in vivo
Исследование с использованием самок голых мышей athymic показало, что мелатонин может контролировать метастатический рак молочной железы за счет снижения экспрессии ROCK-1 [81].
Лечение мелатонином голых мышей с ксенотрансплантатами рака молочной железы уменьшало размер опухоли и пролиферацию клеток по сравнению с контрольными животными, наряду со снижением экспрессии рецептора VEGF 2 и плотности микрососудов, что указывает на ингибирование ангиогенеза [82].
LAN является проблемой, распространенной совместно с раком молочной железы во всем мире [83]. Исследование задокументировало положительное влияние LAN на скорость роста опухолей молочной железы, и мелатонин может обратить вспять этот эффект посредством глобального метилирования ДНК [83].
Другое исследование прояснило связь между LAN-индуцированным нарушением циркадных ритмов и повышенным риском рака молочной железы: LAN нарушал циркадный ритм киназы 3β гликогенсинтазы (GSK3β) через нарушение ночного выброса мелатонина, а мелатонин активировал GSK3β через ингибирование фосфорилирования серин-треонинкиназы Akt и индуцировал деградацию β-катенина и ингибирование EMT [84].
В нескольких исследованиях сообщалось о синергетическом эффекте мелатонина с другими противоопухолевыми средствами при раке молочной железы. Совместное применение мелатонина значительно усилило дифференцирующую, антипролиферативную и иммуномодулирующую активность, представленную Lactobacillus plantarum LS/07 и инулином [85].
Комбинированное лечение мелатонином с Propionibacterium acnes мышей Balb/C, трансплантированных клеточной линией EMT6/P, может ингибировать метастазирование раковых клеток в другие органы, индуцировать апоптоз, снижать ангиогенез и стимулировать сильный противоопухолевый иммунный ответ на цитокины Th1-типа [86].
В другом исследовании сообщалось об усиливающем действии мелатонина на чувствительность опухоли молочной железы к адриамицину [87]. Кроме того, мелатонин может усиливать противоопухолевый эффект правастатина у крыс с карциномой молочной железы, о чем свидетельствует снижение частоты опухолей на 69% и удлинение латентности опухоли на девять дней по сравнению с контрольными животными [88].
Устойчивость к доксорубицину и тамоксифену при раке молочной железы была вызвана LAN-индуцированным нарушением циркадного сигнала мелатонина, а мелатонин может ингибировать метаболизм опухоли и циркадно регулируемую киназу, чтобы восстановить чувствительность опухолей молочной железы к доксорубицину [89] и тамоксифену [90].
В совокупности мелатонин оказывает ингибирующее действие как на ER-положительный, так и на ER-отрицательный рак молочной железы. Эффект мелатонина против рака молочной железы был не только опосредован его взаимодействием как с рецепторами эстрогена, так и с рецепторами мелатонина, но также посредством активации различных независимых от рецепторов и эстрогеннезависимых сигнальных путей.
Учитывая широкий спектр действия мелатонина на рак молочной железы в сочетании с его низкой токсичностью, его можно рассматривать как потенциальный терапевтический выбор для профилактики и лечения рака молочной железы.
Рак предстательной железы
Рак предстательной железы является вторым по частоте встречаемости раком и пятой по значимости причиной смертности от рака у мужчин [91]. Было обнаружено, что мелатонин в фармакологических концентрациях может ингибировать рост клеток как андрогензависимого, так и андрогеннезависимого рака предстательной железы [92] с помощью различных механизмов.
Исследования in vitro
Мелатонин значительно подавлял экспрессию связанных с ангиогенезом белков HIF-1α, HIF-2α и VEGF на уровне мРНК клеток PC-3 в условиях гипоксии, и повышающая регуляция miRNA3195 и miRNA374b могла опосредовать это антиангиогенное свойство мелатонина [93].
Кроме того, мелатонин оказывал антипролиферативное действие на клеточные линии рака предстательной железы, LNCaP и 22Rv1, и механизм мог включать инактивацию NF-κB через индуцируемую мелатониновым рецептором MT1 двойную активацию (Gas) / протеинкиназы A (PKA) и (Gaq) /протеинкиназы C (PKC), вызывающую усиление транскрипции p27Kip1.
Механизм также включал подавление активированной передачи сигналов AR посредством стимуляции PKC [94, 95].
Другое исследование документально подтвердило, что мелатонин подавляет накопление HIF-1α через инактивацию пути сфингозинкиназы 1 и удаление свободных радикалов в гипоксических клетках PC-3, таким образом, мелатонин может действовать как мощная противораковая добавка для терапии рака предстательной железы [96].
Sirt1 (сиртуин 1) представляет собой NAD+-зависимую гистондеацетилазу и сверхэкспрессируется в клетках рака предстательной железы [97]. Мелатонин значительно подавлял активность Sirt1 in vitro в нескольких клеточных линиях рака предстательной железы человека, сопровождающийся значительным снижением пролиферативного потенциала клеток PCa [98].
Мелатонин может вызывать фенотипические изменения, главным образом нейроэндокринную дифференцировку, тем самым повышая чувствительность клеток рака предстательной железы человека к апоптозу, индуцируемому цитокинами, такими как TNF-α или TRAIL [99].
Сверхэкспрессия гена Period 2 (Per2) может привести к значительному снижению роста и жизнеспособности клеток PCa, а лечение мелатонином может ингибировать пролиферацию клеток рака предстательной железы путем ресинхронизации нарушенных схем циркадного ритма посредством усиления регуляции генов Per2 и Clock и снижения регуляции Bmal1 [100].
Исследования in vivo
Дневной синий свет может повышать уровень мелатонина в ночное время, а затем усиливать ингибирование роста рака предстательной железы человека у самцов голых крыс, о чем свидетельствуют сниженные скорости роста опухоли, уровни ЦАМФ в опухоли, аэробный гликолиз (эффект Варбурга), поглощение-метаболизм линолевой кислоты и активность передачи сигналов роста [101].
В другом исследовании мелатонин в ксенотрансплантированных мышам клетках рака предстательной железы человека LNCaP ингибировал скорость роста ксенотрансплантата, оказывая антиангиогенный эффект за счет снижения плотности микрососудов ксенотрансплантата и экспрессии Ki67, а также повышения экспрессии HIF-1α и фосфорилирования Akt. Мелатонин также восстанавливал окислительно-восстановительный дисбаланс, стимулируя экспрессию Nrf2 [102].
Кровь, собранная добровольцами в ночное время и богатая мелатонином, ослабляла передачу сигналов, метаболическую активность и рост в тканевых ксенотрансплантатах рака PC-3 через механизм, опосредованный рецептором мелатонина MT1.
Напротив, кровь, взятая у людей, подвергшихся воздействию локальной сети, оказывала прямо противоположный эффект через подавление ночного циркадного сигнала мелатонина [103].
Кроме того, пероральный прием мелатонина значительно ингибировал онкогенез рака предстательной железы, характеризующийся снижением массы предстательной железы и мочеполовой системы, соотношением IGF-1/IGFBP3 в сыворотке крови, а также уровнями мРНК и белка PCNA и Ki-67, что сопровождалось значительным снижением Sirt1 [98].
В совокупности эти научные публикации подтверждают потенциальное применение мелатонина в профилактике и лечении рака предстательной железы. В частности, мелатонин может оказывать антипролиферативное действие на андрогеннезависимые клетки рака предстательной железы (например, клетки PC-3), что делает мелатонин клиническим выбором для отсрочки рецидива гормонорезистентного или кастрационно-резистентного рака предстательной железы в сочетании с андрогенной депривационной терапией.
Рак яичников
Рак яичников является одной из ведущих причин смерти среди женщин с заболеваниями половых путей [104]. Хотя для лечения рака яичников применялись различные хирургические методы и химиотерапия, прогноз остается плохим [105]. В последние годы в нескольких исследованиях сообщалось о противоопухолевом действии мелатонина на рак яичников.
Исследования in vitro
Мелатонин индуцировал накопление раковых клеток OVCAR-429 и PA-1 яичников в фазе G1 посредством подавления CDK 2 и 4 [106]. Кроме того, хотя мелатонин сам по себе не проявлял значительной цитотоксичности в отношении клеток рака яичников человека SK-OV-3, мелатонин может синергически усиливать цисплатин-индуцированный апоптоз.
Проапоптотический эффект проявлялся через инактивацию каспазы-3 и стимулирование цисплатин-опосредованного ингибирования внеклеточной регулируемой сигналом киназы (ERK), 90-кДа рибосомальной S6-киназы (p90RSK) и фосфорилирования белка теплового шока 27 (HSP27) [107].
Исследования in vivo
Группа изучала онкостатический эффект мелатонина при раке яичников с использованием крысиной модели, предпочитающей этанол, в которой левому яичнику была сделана прививка от опухоли яичника, а правый яичник использовался в качестве контроля после фиктивной операции [108-110].
Они обнаружили, что мелатонин может уменьшать массу опухоли яичников и снижать частоту развития аденокарциномы у крыс [108]. Позже они исследовали стимулирующее апоптоз действие мелатонина на рак яичников.
Результаты показали, что абсолютная и относительная массы опухоли значительно уменьшались после терапии мелатонином, независимо от потребления этанола. Терапия мелатонином способствовала апоптозу, характеризующемуся усилением регуляции р53, BAX и расщепленной каспазы-3, а также усилением фрагментации ДНК [109].
Группа обнаружила, что мелатонин ослаблял индуцированные TLR4 MyD88- и TRIF-зависимые сигнальные пути у крыс с раком яичников [110]. Кроме того, рецепторы эпидермального фактора роста 2 (Her-2) и 4 (Her-4) были тесно связаны с прогрессированием и метастазированием рака яичников [111].
Исследование показало, что мелатонин может ослаблять сигнальный путь Her-2 в модели крыс, предпочитающих этанол, путем значительного подавления экспрессии Her-2, p38 MAPK и p-Akt [112].
В совокупности мелатонин продемонстрировал противоопухолевое действие при раке яичников, и лежащие в его основе механизмы включают индуцирование апоптоза и остановку клеточного цикла, а также иммунорегуляцию (toll-подобные рецепторы).
Рак шейки матки
Рак шейки матки является второй по значимости причиной опухолей у женщин во всем мире, и его частота в развивающихся странах намного выше, чем в развитых странах [113]. В нескольких исследованиях сообщалось о противоопухолевом действии мелатонина на рак шейки матки.
Исследования in vitro
Мелатонин снижал жизнеспособность клеток HeLa и значительно усиливал цитотоксический эффект 3 химиотерапевтических агентов (цисплатин, 5-фторурацил и доксорубицин), о чем свидетельствует повышенная активация каспазы-3.
В частности, совместное лечение мелатонином и цисплатином значительно повышало долю клеток, вступающих в митохондриальный апоптоз, несмотря на перепроизводство АФК, и заметно усиливало фрагментацию ДНК по сравнению с лечением только цисплатином [114].
Исследования in vivo
Мелатонин ингибировал рост ксенотрансплантатов рака шейки матки HeLa, перфузированных in situ голым крысам, посредством ингибирования аэробного гликолиза (эффект Варбурга) и передачи сигналов метаболизма жирных кислот [115].
Кроме того, мелатонин подавлял метаболизм и пролиферацию аденокарциномы шейки матки HeLa посредством ингибирования транспорта линолевой кислоты и выработки 13-гидроксиоктадекадиеновой кислоты посредством рецептор-опосредованной передачи сигнала [116].
Мелатонин может снижать жизнеспособность клеток рака шейки матки in vitro и подавлять метаболизм аденокарциномы шейки матки in vivo. Необходимы дополнительные исследования, чтобы полностью объяснить онкостатический эффект мелатонина при раке шейки матки и поддержать клиническое применение мелатонина.
Рак эндометрия
Рак эндометрия, как и рак молочной железы, является эстрогензависимым новообразованием, и его заболеваемость быстро растет во всем мире [117, 118]. О влиянии мелатонина на рак эндометрия сообщалось лишь в нескольких исследованиях.
Исследования in vivo
Висцеральное ожирение является фактором риска развития рака эндометрия, поскольку оно связано с хроническим воспалительным процессом [119].
Ciortea et al. сообщалось, что по сравнению с заместительной терапией эстрогенами комбинированное лечение мелатонином и эстрогеном у крыс, подвергшихся овариэктомии, было связано с более низкой массой тела, меньшим количеством внутрибрюшинного жира, уменьшением пролиферации эндометрия и меньшим проявлением клеточной атипии.
Эти результаты показали, что добавки мелатонина могут быть использованы для профилактики рака эндометрия у женщин в менопаузе [119].
Гормонально-независимые виды рака
Рак полости рта
Рак полости рта является распространенным типом рака головы и шеи человека, и большинство случаев связано с плоскоклеточным раком полости рта [120]. В нескольких исследованиях in vitro мелатонин продемонстрировал заметное влияние на рак полости рта.
В исследовании мелатонин продемонстрировал противометастатическое действие на клеточные линии рака полости рта (HSC-3 и OECM-1) за счет ослабления экспрессии и активности MMP-9, что было опосредовано снижением ацетилирования гистонов [121].
Кроме того, мелатонин может снижать клеточную жизнеспособность клеточных линий SCC9 и SCC25 (обе плоскоклеточные карциномы языка) и оказывать ингибирующее действие на экспрессию прометастатического гена, ROCK-1, и проангиогенных генов, HIF-1α и VEGF в клеточной линии SCC9 [122].
В совокупности мелатонин продемонстрировал ингибирующее действие на некоторые клетки рака полости рта, и лежащие в его основе механизмы в основном включали ингибирование метастазирования и ангиогенеза.
Рак печени
Рак печени является второй по распространенности причиной смерти от рака во всем мире, а гепатоцеллюлярная карцинома (ГЦК) является основным видом рака печени (70-80%), который является одним из наиболее частых видов рака с самой высокой заболеваемостью в развивающихся странах [123, 124].
Хирургическое вмешательство остается наиболее эффективным методом лечения пациентов с ГЦК, но оно подходит только в ограниченных случаях, поэтому требуется поиск эффективного химиотерапевтического препарата [125]. О влиянии мелатонина на рак печени сообщалось в нескольких исследованиях.
Исследования in vitro
Исследование выявило основной механизм противоинвазивной активности мелатонина в клетках рака печени HepG2, который заключался в подавлении активности желатиназы MMP-9, понижении экспрессии гена MMP-9, усилении регуляции тканевого ингибитора металлопротеиназ (TIMP)-1 и угнетении транслокации NF-κB и транскрипционной активности [126].
Мелатонин также проявлял антиангиогенное действие на клетки рака печени HepG2, вмешиваясь в активацию транскрипции VEGF, снижая экспрессию белка Hif1a и активность STAT3 [127].
Установлено, что белки-ингибиторы апоптоза (IAPs) играют решающую роль в устойчивости к апоптозу, и в одном исследовании задокументировано, что мелатонин может преодолевать устойчивость к апоптозу при гепатоцеллюлярной карциноме человека путем подавления сурвивина и XIAP (оба являются членами IAPs) через путь COX-2/PI3K /AKT [128].
Кроме того, мелатонин оказывал проапоптотическое действие посредством усиления экспрессии Bcl-2-взаимодействующего медиатора (Bim) FOXO3a в клетках гепатокарциномы HepG2, посредством активации фактора транскрипции FOXO3a и увеличения его ядерной локализации.
Между тем, индуцированный апоптоз не наблюдался в первичных гепатоцитах человека (использованных в качестве контроля) [129]. Другое исследование документально подтвердило, что мелатонин снижает жизнеспособность клеток и ингибирует пролиферацию клеток HepG2, которая модулируется мембранным рецептором MT1.
Снижение уровня цАМФ и увеличение активации ERK, вызванные мелатонином, также были ответственны за ингибирующий эффект [130]. Стресс-опосредованный апоптоз клеток эндоплазматического ретикулума (ER) участвует в развитии и прогрессировании рака.
Другое исследование показало, что мелатонин может повышать чувствительность клеток гепатомы человека к ER-индуцированному стрессом апоптозу посредством снижения экспрессии ЦОГ-2 и соотношения Bcl-2/Bax, а также повышения уровней гомологичного белка C / EBP (CHOP) [131].
Исследования in vivo
В исследовании мелатонин обратил вспять изменения, вызванные опухолью печени, вызванной N-нитрозодиэтиламином, в маркерных ферментах печени (ALT, AST), уровнях антиоксидантов и нарушении циркадных часов у мышей [132]. Другое исследование показало, что мелатонин ослаблял гепатоканцерогенез, индуцированный диэтилнитрозамином у крыс, путем активации ER-стресса и индуцирования апоптоза [133].
В совокупности мелатонин может ингибировать процесс гепатоканцерогенеза главным образом за счет проапоптотического (через модуляцию пути COX-2 / PI3K / AKT, соотношения Bcl-2 / Bax, активации ER-стресса), антиангиогенеза и противоинвазивных эффектов.
Рак почки
Рак почки является высокоагрессивным и третьим по распространенности урологическим раком, на долю которого приходится примерно 3% случаев рака у взрослых с преобладанием мужчин (соотношение полов 3/1) [134]. Обобщены исследования противоопухолевого действия мелатонина на рак почки.
Исследования in vitro
В недавнем исследовании систематически изучалось противометастатическое действие мелатонина на почечно-клеточный рак (ПКР) [135]. Мелатонин ингибировал трансактивацию MMP-9 и метастазирование опухоли, ингибируя путь Akt-MAPKs и ДНК-связывающую активность NF-κB.
Более того, анализ клинических образцов выявил более высокую выживаемость у пациентов с высоким содержанием MTNR1A/MMP-9 низким уровнем, чем у пациентов с низким содержанием MTNR1A/MMP-9 высоким уровнем [135].
Мелатонин также индуцировал апоптоз путем усиления экспрессии Bim в клетках рака почки Caki, как на уровне транскрипции, так и на посттрансляционном уровне [136]. Кроме того, совместное лечение мелатонином (1 мм) и тапсигаргином (50 нМ) индуцировало больший апоптоз в клетках рака почки человека, чем лечение одним тапсигаргином, что происходило за счет ROS-опосредованной активации гомологичного белка, связывающего CCAAT-энхансер-связывающий белок [137].
Совместное применение мелатонина и кахвеола индуцировало апоптоз, стимулировало активность ДЕВДазы (может отражать активность каспазы-3) и фрагментацию ДНК клеток рака почки Caki. Механизм, лежащий в основе, был выяснен как индуцирующий повышенную регуляцию р53-повышенного модулятора апоптоза [138].
В совокупности индуцирование апоптоза и ингибирование метастазирования являются основными эффектами мелатонина на клетки рака почки. Более того, одновременное применение мелатонина с другими видами терапии может быть эффективным клиническим выбором для пациентов с раком почки, учитывая, что мелатонин оказывал усиливающее действие на другие противоопухолевые средства.
Рак легких
Рак легких является основной причиной смертности от рака. Например, рак легких является вторым по частоте типом рака у мужчин: в 2016 году в Бразилии было выявлено примерно 17 330 новых случаев [139].
Немелкоклеточный рак легких (НМРЛ) является основной формой рака легких [140], и опубликованная литература предполагает, что нарушение ритма выработки мелатонина может увеличить частоту развития НМРЛ [141].
В нескольких исследованиях сообщалось, что мелатонин является потенциальной терапевтической стратегией при раке легких, главным образом потому, что было показано, что мелатонин усиливает эффекты лучевой терапии и некоторых противоопухолевых препаратов.
Исследования in vitro
В ходе исследования было обнаружено, что в раковых клетках с дефицитом клеточного цикла и регулятора апоптоза 2 (CCAR2) мелатонин усиливает апоптоз, индуцированный генотоксическим стрессом, вызванным ультрафиолетовым облучением.
Результаты показали, что мелатонин может быть потенциальным дополнением к классическим противоопухолевым препаратам в терапии рака с дефицитом CCAR2 [142]. Кроме того, мелатонин значительно подавлял миграцию и жизнеспособность клеток A549, что могло быть вызвано снижением экспрессии остеопонтина, киназы легкой цепи миозина, фосфорилированием легкой цепи миозина и повышением экспрессии окклюдина с участием пути JNK/MAPK [143].
Исследование показало, что мелатонин эффективно усиливал индуцированное берберином торможение клеточной пролиферации, миграции и апоптоза. Усиливающий эффект, возможно, был обусловлен активацией каспазы/Cytoc и ингибированием сигнальных путей AP-2β/hTERT, NF-κB/COX-2 и Akt/ERK [140].
Использование ингибиторов тирозинкиназы EGFR (TKI) для лечения пациентов с НМРЛ на поздних стадиях стало стандартом лечения, но пациенты с НМРЛ с соматическими мутациями EGFR, в частности T790M, проявляли лекарственную устойчивость к TKI.
Лечение мелатонина гефитинибом (тип TKI) эффективно снижало жизнеспособность клеток H1975, содержащих соматическую мутацию T790M, снижало фосфорилирование EGFR и индуцировало апоптоз по сравнению с лечением только гефитинибом или мелатонином [144].
Судя по имеющимся данным, эффект мелатонина был более значительным, когда он использовался в качестве вспомогательной терапии, чем при самостоятельном лечении рака легких.
Усиление действия мелатонина на терапевтические эффекты гефитиниба, берберина и доксорубицина продемонстрировало его благоприятную роль в профилактике и лечении рака легких.
Рак желудка
Рак желудка является одной из наиболее распространенных форм рака во всем мире и вызывает смертность, занимающую второе место среди злокачественных опухолей во всем мире [145].
По оценкам, в 2012 году во всем мире было зарегистрировано 951 600 новых случаев и 723 100 смертей от рака желудка [146]. В нескольких исследованиях сообщалось, что мелатонин подавляет рак желудка с помощью различных механизмов.
Исследования in vitro
В исследовании мелатонин ингибировал накопление HIF-1α и генерацию эндогенного VEGF посредством ингибирования RZR/RORy в гипоксических клетках SGC-7901, тем самым ингибируя пролиферацию раковых клеток желудка [147].
елатонин инМгибировал ангиогенез в клеточной линии рака желудка SGC-7901, о чем свидетельствует снижение экспрессии мРНК и белка VEGF и подавление экспрессии мРНК и белка ядерного рецептора RZR/RORy [148].
Также мелатонин был способен ингибировать жизнеспособность клеток, образование клонов, миграцию клеток и инвазию, а также индуцировать апоптоз клеточной линии рака желудка AGS посредством активации JNK и P38 MAPK и подавления NF-κB.
Мелатонин значительно усиливал противоопухолевый эффект цисплатина с низкой системной токсичностью [149]. Ингибирующие эффекты мелатонина на клеточную пролиферацию, колониеобразование и эффективность миграции, а также проапоптотический эффект были также показаны на клеточной линии SGC7901 аденокарциномы желудка [150].
Кроме того, мелатонин ингибировал рост клеток мышиной карциномы переднего желудка (MFC) в зависимости от дозы и времени, посредством увеличения p21 и Bax и снижения Bcl-2, что было опосредовано мембранными рецепторами мелатонина [151].
В другом исследовании мелатонин стимулировал дозозависимый апоптоз и индуцировал остановку клеточного цикла на фазе G2/M в клетках MFC, и этот механизм был связан с понижением регуляции CD4+ и CD25+ регуляторных Т-клеток и экспрессии его раздвоенного бокса p3 (Foxp3) в опухолевой ткани [152].
Клетки рака желудка SGC7901, культивированные с мелатонином, показали более дифференцированный морфологический фенотип по сравнению с необработанными клетками, сопровождающийся повышением экспрессии гена endocan и понижением активности щелочной фосфатазы и лактатдегидрогеназы, двух ферментов, которые способствуют дедифференцировке в ткани желудка [153].
Исследования in vivo
Исследование показало, что индуцируемое мелатонином подавление C / EBPβ и NF-κB может препятствовать как росту опухоли желудка, так и распространению по брюшине через ингибирование EMT и индуцирование стресса ER [154].
Мелатонин уменьшал объем и массу опухоли у мышей-носителей опухоли желудка nude и ингибировал пролиферацию и ангиогенез за счет подавления экспрессии RZR/RORy, Сентри-специфической протеазы 1 (SENP1), HIF-1α и VEGF [148].
В другом исследовании мышам инокулировали клетки MFC и вводили различные дозы мелатонина (0, 25, 50 и 100 мг/кг внутривенно). Результаты показали, что в опухолевой ткани уменьшалось количество Tregs и экспрессия Foxp3 в опухолевой ткани подавлялись обработкой мелатонином [152].
В целом, мелатонин продемонстрировал заметный ингибирующий эффект на рост раковых клеток желудка. Лежащие в основе механизмы в основном включали ингибирование ангиогенеза, стимулирование апоптоза и эффект иммунорегуляции.
Рак поджелудочной железы
Рак поджелудочной железы является высокосмертельным заболеванием с относительно низкой 5-летней выживаемостью [155, 156]. Он плохо поддается лучевой терапии и химиотерапии, поскольку опухолевые клетки устойчивы к апоптозу [157].
Исследования in vitro
В исследовании концентрация мелатонина в 1 мм проявляла высокий ингибирующий эффект на клеточную пролиферацию клеток карциномы поджелудочной железы (PANC-1) наряду со значительным снижением VEGF [158].
Мелатонин снижал жизнеспособность клеток AR42J опухоли поджелудочной железы путем индуцирования изменений митохондриальной активности и активации каспазы-3 [159]. Кроме того, мелатонин отдельно или в сочетании с гемицитабином проявлял ингибирование роста клеточной линии рака поджелудочной железы SW-1990.
Механизм заключался в снижении экспрессии Bcl-2 и повышении экспрессии Bax [160]. Кроме того, мелатонин усиливал цитотоксичность и апоптоз, индуцируемые 3 химиотерапевтическими агентами (5-фторурацил, цисплатин и доксорубицин) в раковых клетках поджелудочной железы AR42J in vitro [161].
Усиливающий эффект характеризовался повышением внутриклеточной продукции АФК, усиленной деполяризацией митохондриальной мембраны и увеличением популяции апоптотических клеток.
Исследования in vivo
В исследовании мелатонин сам по себе или в сочетании с гемицитабином ингибировал рост трансплантированных опухолей у мышей nude благодаря своему проапоптотическому и пронекротическому эффекту, через понижающую регуляцию экспрессии Bcl-2 и повышающую экспрессию Bax [160].
Мелатонин может улучшать противоопухолевую активность капецитабина при раке поджелудочной железы [162]. Результаты показали, что в группе лечения только капецитабином и мелатонином аденокарцинома поджелудочной железы, индуцированная N-нитрозобис(2-оксопропил) амином, наблюдалась у 66% и 33% животных соответственно.
Однако в группе, получавшей комбинацию капецитабина и мелатонина, только у 10% животных обнаружилась аденокарцинома поджелудочной железы.
В целом, мелатонин показал ингибирование роста некоторых раковых клеток поджелудочной железы. Кроме того, мелатонин может повышать эффективность других противоопухолевых средств при раке поджелудочной железы, особенно гемцитабина, который в настоящее время является стандартной химиотерапией при раке поджелудочной железы.
Колоректальный рак
Колоректальный рак является одной из основных причин, ответственных за смертность от рака во всем мире [163], и в нескольких исследованиях мелатонин продемонстрировал противоопухолевую эффективность при различных видах колоректального рака.
Исследования in vitro
Исследование показало, что мелатонин повышает уровни АФК и снижает клеточную жизнеспособность клеток колоректальной карциномы человека HCT 116 [164].
Онкостатический эффект мелатонина также был связан с его антиоксидантной и противовоспалительной активностью, противодействующей окислительному статусу и ингибирующей выработку оксида азота в культивируемых клетках рака толстой кишки [165].
В другом исследовании пролиферация клеток была значительно подавлена, а апоптоз индуцировался мелатонином на клетках ЛоВо колоректального рака в фармакологических концентрациях дозозависимым образом [166].
Механизм, лежащий в основе, был объяснен как ядерный импорт гистондеацетилазы 4 (HDAC4) и последующее деацетилирование H3 посредством инактивации Ca2 + / кальмодулин-зависимой протеинкиназы IIa (CaMKII).
Эндотелин-1 (ET-1) представляет собой пептид, который действует как защитник клеток карциномы от апоптоза и промотор ангиогенеза [167]. Исследование показало, что мелатонин может ингибировать рост опухоли и прогрессирование рака толстой кишки посредством подавления активации ET-1 [168].
В другом исследовании изучался ультраструктурный аспект цитотоксичности мелатонина на клеточной линии аденокарциномы толстой кишки человека Caco-2.
Результаты показали, что ультраструктурно клетки Caco-2 демонстрировали морфологические изменения при обработке мелатонином в дозах 1,56 и 0,78 мкг / мл с признаками дегенерации клеток, о чем свидетельствует отсутствие микроворсинок, дегенерация митохондрий, наличие многочисленных вакуолей и фрагментация ядер, указывая на то, что мелатонин может способствовать цитотоксичности клеток Caco-2 [169].
Кроме того, исследование определило взаимосвязь между гибелью клеток и клеточным старением в клетках колоректального рака человека, индуцированных мелатонином [170].
Лечение мелатонином в дозе 10 мкм активировало программы гибели клеток и индуцировало остановку фазы G1 на продвинутой стадии раковых клеток, а также оказывало незначительное вредное воздействие на кардиомиоциты новорожденных по сравнению с трихостатином А.
В исследовании сообщалось о значительном снижении экспрессии мРНК рецептора мелатонина MT1 при колоректальном раке по сравнению со здоровой прилегающей тканью слизистой оболочки [171].
Мелатонин также продемонстрировал синергический эффект с другими противоопухолевыми средствами при колоректальной опухоли. Комбинация урсоловой кислоты и мелатонина привела к усилению антипролиферативной и проапоптотической активности в клеточных линиях рака толстой кишки SW480 и LoVo.
Усиленные эффекты проявлялись через цитохром с/каспазу, MMP9/COX-2 и сигнальные пути p300/NF-κB [172].
Исследования in vivo
В исследовании изучалось влияние мелатонина на мышиную модель канцерогенеза толстой кишки, связанного с колитом (CACC). Мелатонин замедлял прогрессирование CACC, подавляя процесс аутофагии и снижая уровень нескольких маркеров воспаления.
Мелатонин также увеличивал экспрессию Nrf2 и связанных с ним антиоксидантных ферментов в толстой кишке мышей с CACC [173]. Постоянная световая среда связана с высокой частотой рака толстой кишки, главным образом вызывая нарушения в нейроэндокринной системе толстой кишки [174].
В исследовании анализировали предраковые структуры в ткани толстой кишки животных, подвергавшихся постоянному освещению (14 дней; 300 лк), и наблюдали индукцию развития аберрантных очагов крипты (ACF), характеризующихся увеличением числа + CD133 и + CD68 клеток.
Также наблюдалось усиление пролиферативного процесса и снижение белка каспазы-3. Однако вышеуказанные изменения были обращены вспять приемом добавок мелатонина путем контроля развития диспластического ACF и пренеопластических паттернов.
Эти результаты указывают на то, что мелатонин обладает большим потенциалом для контроля предраковых паттернов, индуцируемых постоянным светом [175].
В совокупности мелатонин мог бы стать новой привлекательной терапевтической стратегией при колоректальном раке, поскольку он может регулировать канцерогенез, развитие и прогрессирование колоректального рака. Лежащие в основе механизмы включают множество сигнальных путей, включая регуляцию сигнальных путей CaMKII, ET-1, Nrf2 и индукцию ACF.
Другие виды рака
Противоопухолевый эффект мелатонина также наблюдался при меланоме. Исследование показало, что мелатонин в сочетании с ER-стрессом (индуцированным тапсигаргином или туникамицином) снижал жизнеспособность клеток меланомы B16F10, через путь PI3K/Akt / mTOR [176].
Кроме того, мелатонин усиливал противоопухолевую активность физетина в клетках меланомы, о чем свидетельствует усиленное ингибирование жизнеспособности клеток, клеточной миграции и образования клонов, а также усиление апоптоза.
Возможный механизм может заключаться в активации цитохром с-зависимого пути апоптоза и ингибировании сигнальных путей COX-2/iNOS и NF-kB/p300 [177].
В другом исследовании низкие концентрации мелатонина (10-9-10-5 М) подавляли пролиферацию клеток меланомы B16 без ингибирования фибробластов, в то время как высокие концентрации (10-4-10-2 М) подавляли жизнеспособность клеток меланомы, но ингибирующая активность была не такой выраженной, как у неопухолевых клеток (фибробласты 3T3).
Выработка АФК может способствовать ингибированию жизнеспособности клеток, индуцируемой мелатонином, при высоких концентрациях мелатонина [178].
Мелатонин также продемонстрировал противораковое действие на опухоль, секретирующую пролактин гипофиза. В исследовании мелатонин индуцировал апоптоз опухолевых клеток пролактиномы посредством индуцирования митохондриальной дисфункции и ингибирования энергетического обмена, как in vivo (самцы крыс), так и in vitro (клетки пролактиномы) [179].
Повышенные уровни активности четырех митохондриальных дыхательных комплексов и выработки АТФ наблюдались в E-2-индуцированных опухолевых клетках, секретирующих пролактин, и мелатонин подавлял активность митохондриальных дыхательных комплексов и выработку АТФ.
Мелатонин также продемонстрировал противоопухолевое действие на лейомиосаркому человека (LMS) [180]. Мелатонин продемонстрировал значительное ингибирующее действие на ксенотрансплантаты человеческой пленки, изолированные тканью, путем подавления аэробного гликолиза (эффект Варбурга) и поглощения опухолью линолевой кислоты и других связанных с этим сигнальных механизмов.
Мелатонин в физиологической концентрации также ингибировал клеточную пролиферацию и клеточную инвазию в исследованиях на культуре клеток in vitro. Другое исследование показало, что мелатонин способен индуцировать гибель клеток альвеолярной линии рабдомиосаркомы человека в зависимости от дозы и времени [181].
Кроме того, обработка мелатонином в дозах 150 и 300 мкг/30 г массы тела в течение 12 дней подряд могла индуцировать очень эффективную онкостатическую и цитотоксическую активность у мышей, инкубированных с опухолевыми клетками асцита Эрлиха [182].
Мелатонин проявлял антиапоптотическое действие на лимфоциты и нейтрофилы, полученные от крыс, которым вводили лейкозные клетки HL-60, о чем свидетельствует значительное ингибирование активности каспазы-3 и -9 и возвращение пропорций лимфоцитов, нейтрофилов и эозинофилов к их базовым значениям [183].
Также мелатонин индуцировал гибель клеток в линиях злокачественных гематологических клеток человека, посредством активации внешнего пути апоптоза, регулируемого улучшением экспрессии рецепторов смерти Fas, DR4 и DR5 и их лигандов Fas L и TRAIL [184].
В исследовании изучалось влияние мелатонина на различные раковые клетки, включая клетки аденокарциномы легкого A549, клетки хондросаркомы sw-1353, клетки глиобластомы A172 и клетки острого миелоидного лейкоза человека HL-60.
Был обнаружен двойной эффект мелатонина на внутриклеточное окислительно-восстановительное состояние. То есть онкостатический эффект мелатонина зависел от его способности индуцировать либо антиоксидантную среду (приводящую к антипролиферативному эффекту в некоторых опухолях), либо прооксидантную среду (приводящую к цитотоксическому эффекту в некоторых опухолях) [185].
Мелатонин в сочетании с некоторыми химиотерапевтическими препаратами может оказывать синергическое токсическое действие на клетки злокачественной глиомы A172 и стволовые клетки опухоли головного мозга [186], посредством подавления экспрессии и функции аденозинтрифосфатсвязывающего кассетного транспортера ABCG2/BCRP, избыточная экспрессия которого в злокачественных глиобластомах ответственна за множественную лекарственную устойчивость и рецидив опухоли.
Мелатонин продемонстрировал синергический противоопухолевый эффект с винкристином и ифосфамидом на раковые клетки саркомы Юинга человека SK-N-MC, усиливая внешний апоптоз [187].
Противоопухолевый эффект мелатонина и возможные механизмы действия обобщены в таблице 2, таблице 3 и рисунке 3, а синергические эффекты мелатонина с другой химиотерапией или лучевой терапией обобщены в таблице 4.
 Таблица 2. Влияние мелатонина in vitro и in vivo на гормонозависимые виды рака
Таблица 2. Влияние мелатонина in vitro и in vivo на гормонозависимые виды рака  Таблица 3. Активность мелатонина in vitro и in vivo при гормонально-независимых раковых заболеваниях
Таблица 3. Активность мелатонина in vitro и in vivo при гормонально-независимых раковых заболеваниях Таблица 4. Синергетический эффект мелатонина с другими противоопухолевыми препаратами или лучевой терапией
Таблица 4. Синергетический эффект мелатонина с другими противоопухолевыми препаратами или лучевой терапией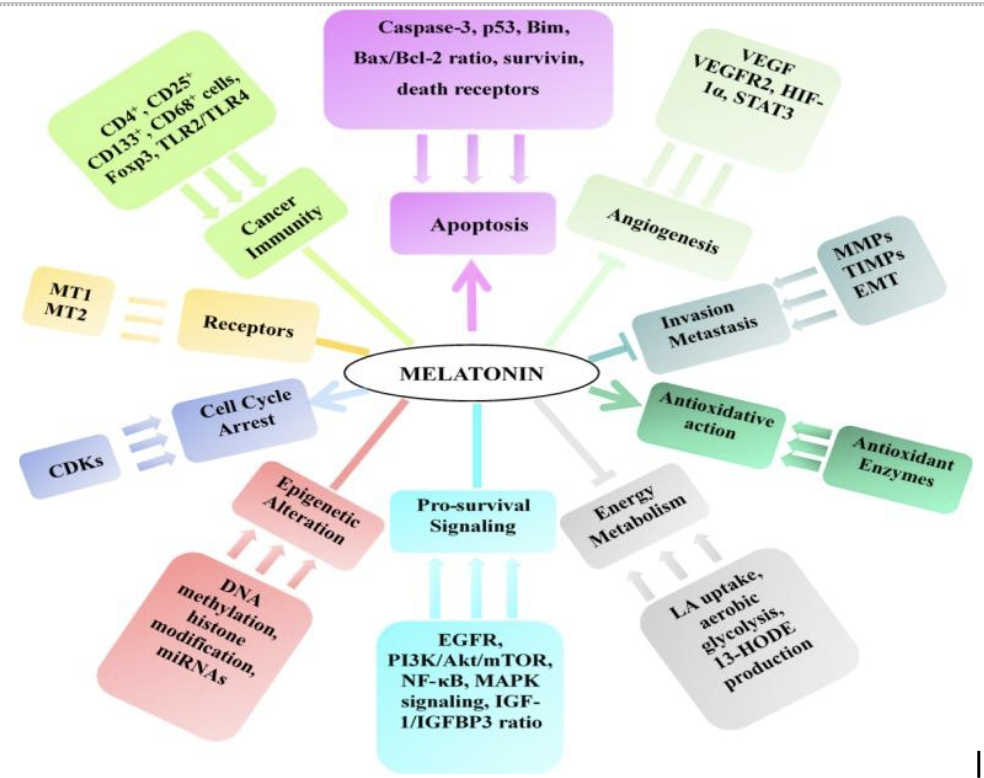 Рисунок 3. Механизмы противоопухолевого действия мелатонина
Рисунок 3. Механизмы противоопухолевого действия мелатонина→ обозначает стимулирование, - обозначает регулирование и — обозначает подавление.
КЛИНИЧЕСКИЕ ИСПЫТАНИЯ
В клинических испытаниях, касающихся противоопухолевого эффекта мелатонина, мелатонин в основном использовался в качестве вспомогательной терапии с другими химиотерапевтическими препаратами.
Несколько клинических исследований показали, что мелатонин может повышать терапевтическую эффективность и снижать токсичность других противоопухолевых препаратов, о чем свидетельствует усиление частичного ответа, индуцированная регрессия опухоли, более высокая выживаемость и облегчение симптомов побочных эффектов.
По данным клинического исследования, лечение низкими дозами подкожного интерлейкина-2 (3 млн МЕ/ сут в течение 6 дней в неделю в течение 4 недель) плюс мелатонин (40 мг/сут перорально) значительно увеличили годичную выживаемость пациентов с метастатическим колоректальным раком по сравнению с одной поддерживающей терапией (9/25 против. 3/25, р < 0,05) [188].
В исследовании II фазы, включавшем 14 пациентов с метастатическим раком молочной железы, пероральный прием мелатонина в дозе 20 мг / сут, начатый за 7 дней до терапии тамоксифеном, достиг частичного ответа у 4/14 (28,5%) пациентов, вызвал облегчение тревоги у большинства пациентов и не усилил токсичность тамоксифена.
Уровни IGF-1 в сыворотке были снижены в результате комбинированной терапии [189]. В другом клиническом исследовании также сообщалось, что мелатонин может повысить эффективность химиотерапии и снизить токсичность у пациентов с метастатической солидной опухолью [190].
В клиническом исследовании оценивался эффект одновременного приема мелатонина (20 мг / сут перорально вечером) у пациентов с метастатическим раком НМРЛ, получавших химиотерапевтический режим, состоящий из цисплатина и этопозида.
Пациенты, получавшие сопутствующий прием мелатонина, показали более высокую общую скорость регрессии опухоли и 5-летнюю выживаемость при лучшей переносимости химиотерапии [191].
Аналогичным образом, сопутствующий прием мелатонина с иринотеканом обеспечивал более высокий процент контроля заболевания у пациентов с метастатическим колоректальным раком, чем прием только иринотекана, поскольку частичный ответ и стабильное течение заболевания были достигнуты у большего числа пациентов [192].
В нескольких исследованиях сообщалось, что мелатонин может улучшать сон и качество жизни у пациентов с раком молочной железы. В проспективном исследовании фазы II прием мелатонина перед сном был связан со значительным улучшением объективного качества сна, субъективного сна, фрагментации и количества сна, тяжести усталости, глобального качества жизни, а также шкал социального и когнитивного функционирования [193].
Кроме того, двойное слепое, плацебо-контролируемое, рандомизированное клиническое исследование показало, что риск развития симптомов депрессии у субъектов, получавших 6 мг мелатонина перорально, был значительно ниже, чем у субъектов, принимавших плацебо [194].
Вторичные результаты этого исследования показали, что пероральное введение мелатонина в дозе 6 мг примерно за 1 час до сна привело к значительному улучшению эффективности сна и уменьшению пробуждения после начала сна в течение 2-недельного послеоперационного периода [195].
В другом рандомизированном плацебо-контролируемом исследовании утверждалось, что по сравнению с субъектами, принимавшими плацебо, субъекты, получавшие мелатонин, сообщили о значительном повышении субъективного качества сна, измеряемого с помощью Питтсбургского индекса качества сна (PSQI) [196].
Другое исследование показало, что мелатонин в сочетании с соматостатином, ретиноидами, витамином D3 и низкой дозой циклофосфамида оказывал положительное действие с точки зрения эффективности и выживаемости при раке молочной железы у человека [197].
Однако в двойном слепом плацебо-контролируемом исследовании сообщалось, что краткосрочное лечение мелатонином не оказывало какого-либо существенного влияния на уровни эстрадиола и IGF-1/IGBBP-3 у женщин с раком молочной железы 0-III стадий в анамнезе [198].
Другое двойное слепое плацебо-контролируемое перекрестное исследование, в котором приняли участие 72 пациента, показало, что пероральный прием мелатонина в дозе 20 мг не способен улучшить утомляемость или другие симптомы у пациентов с распространенным раком [199].
В совокупности в ходе клинических испытаний мелатонин продемонстрировал способность усиливать терапевтический эффект различных противоопухолевых препаратов. Между тем, мелатонин может помочь улучшить сон и качество жизни онкологических больных.
ВЫВОДЫ И ПЕРСПЕКТИВЫ
Эффекты мелатонина при раковых заболеваниях широко изучались, с акцентом на гормонозависимые виды рака. Эпидемиологические исследования, касающиеся связи между циркадными уровнями мелатонина в организме и заболеваемостью раком, привели к противоречивым выводам, которые были либо значительной ассоциацией, либо отсутствовали вообще.
Многочисленные экспериментальные исследования показали онкостатическую роль мелатонина при различных видах рака, таких как рак молочной железы, яичников, предстательной железы, полости рта, желудка и колоректального рака.
Лежащие в основе механизмы включают несколько молекулярных путей, которые связаны с антиоксидантной активностью, модуляцией мелатониновых рецепторов MT1 и MT2, регуляцией апоптоза, сигнализацией, способствующей выживанию, и метаболизмом опухоли, ингибированием ангиогенеза, инвазии и метастазирования и индукцией эпигенетических изменений.
Мелатонин также продемонстрировал потенциал для использования в качестве вспомогательного средства при лечении рака, усиливая терапевтический эффект и уменьшая побочные эффекты химиотерапии или облучения.
В ходе клинических испытаний мелатонин продемонстрировал способность усиливать терапевтический эффект различных противоопухолевых препаратов и может помочь улучшить сон и качество жизни онкологических больных.
В целом, впечатляющая эффективность и безопасность мелатонина подтверждают его как перспективное средство для профилактики и лечения раковых заболеваний.
В будущем необходимо продолжить изучение нескольких аспектов противоопухолевого действия мелатонина. Для эпидемиологических исследований основной проблемой является несоответствие результатов.
Это может быть связано с тем, что использовались разные виды образцов, время сбора образцов и методы оценки содержания мелатонина. Поэтому необходимо сравнивать различные методы оценки содержания мелатонина, и в будущих исследованиях следует использовать наиболее надежный.
Кроме того, необходимо изучить влияние различных видов образцов (таких как моча, плазма или сыворотка) на результаты, и следует использовать образцы одного и того же типа. Кроме того, следует определить наиболее подходящее время взятия пробы, поскольку концентрация мелатонина в организме человека изменяется в зависимости от циркадного ритма.
Что касается экспериментальных исследований, то следует отметить, что мелатонин регулирует физиологию и молекулярную биологию клеток посредством различных механизмов, а рак является гетерогенным заболеванием.
Следовательно, противоопухолевая эффективность мелатонина не ограничивалась вышеупомянутыми механизмами действия. Что касается заболеваемости, то аутофагия является характерной особенностью запрограммированной клеточной гибели, и исследований влияния мелатонина на аутофагию в раковых клетках очень мало.
В литературе также описано благотворное воздействие мелатонина на митохондриальную дисфункцию при различных патологиях. Таким образом, существует вероятность того, что онкостатический эффект мелатонина связан с митофагией.
Однако соответствующих исследований по этой теме недостаточно. Таким образом, будущие исследования могут охватывать влияние мелатонина на аутофагию и митофагию, а также другие молекулярные механизмы, участвующие в его противоопухолевом действии.
Для клинических испытаний следует дополнительно оценить усиливающий эффект мелатонина на большее количество противоопухолевых препаратов.
Также следует изучить его прямое воздействие на пациентов с манифестным раком путем экзогенного введения мелатонина, чтобы выявить его онкостатические эффекты при некоторых видах рака и предоставить информацию о дозировке и долгосрочной безопасности мелатонина. Механизмы действия должны быть исследованы дополнительно.
Благодарность
Эта работа была поддержана Национальным фондом естественных наук Китая (№ 81372976), Ключевым проектом Научно-технической программы провинции Гуандун (№ 2014B020205002) и программой "Сто талантов" Университета Сунь Ятсена.
Список литературы
1. Grant SG, Melan MA, Latimer JJ, Witt-Enderby PA. Melatonin and breast cancer: Cellular mechanisms, clinical studies and future perspectives. Expert Rev Mol Med. 2009;11:e5. [PMC free article] [PubMed] [Google Scholar]
2. Acuña-Castroviejo D, Escames G, Venegas C, Díaz-Casado ME, Lima-Cabello E, López LC, Rosales-Corral S, Tan D, Reiter RJ. Extrapineal melatonin: Sources, regulation, and potential functions. Cell Mol Life Sci. 2014;71:2997–3025. [PubMed] [Google Scholar]
3. Ekmekcioglu C. Melatonin receptors in humans: Biological role and clinical relevance. Biomed Pharmacother. 2006;60:97–108. [PubMed] [Google Scholar]
4. Li AN, Xu XR, Li S, Guo YJ, Liu JL, Li HB. Secretion and bioactivity of melatonin. Int J Mod Biol Med. 2012;1:21–39. [Google Scholar]
5. Stehle JH, Saade A, Rawashdeh O, Ackermann K, Jilg A, Sebestény T, Maronde E. A survey of molecular details in the human pineal gland in the light of phylogeny, structure, function and chronobiological diseases. J Pineal Res. 2011;51:17–43. [PubMed] [Google Scholar]
6. Reiter RJ. Pineal melatonin: Cell biology of its synthesis and of its physiological interactions. Endocr Rev. 1991;12:151–180. [PubMed] [Google Scholar]
7. Stehle JH, Von Gall C, Korf HW. Melatonin: A clock-output, a clock-input. 2003;15:383–389. [PubMed] [Google Scholar]
8. Slominski RM, Reiter RJ, Schlabritz-Loutsevitch N, Ostrom RS, Slominski AT. Melatonin membrane receptors in peripheral tissues: Distribution and functions. Mol Cell Endocrinol. 2012;351:152–166. [PMC free article] [PubMed] [Google Scholar]
9. Stevens RG, Brainard GC, Blask DE, Lockley SW, Motta ME. Breast cancer and circadian disruption from electric lighting in the modern world. CA Cancer J Clin. 2014;64:207–218. [PMC free article] [PubMed] [Google Scholar]
10. WHO 2015 Available online: http://www.who.int/mediacentre/factsheets/fs297/en/ (accessed on 17 September 2016)
11. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016. CA Cancer J Clin. 2016;66:7–30. [PubMed] [Google Scholar]
12. Zhang JJ, Li Y, Zhou T, Xu DP, Zhang P, Li S, Li HB. Bioactivities and health benefits of mushrooms mainly from China. Molecules. 2016;21:938. [PMC free article] [PubMed] [Google Scholar]
13. Li Y, Zhang JJ, Xu DP, Zhou T, Zhou Y, Li S, Li HB. Bioactivities and health benefits of wild fruits. Int J Mol Sci. 2016;17:1258. [PMC free article] [PubMed] [Google Scholar]
14. Zhou Y, Zheng J, Li Y, Xu DP, Li S, Chen YM, Li HB. Natural polyphenols for prevention and treatment of cancer. Nutrients. 2016;8:515. [PMC free article] [PubMed] [Google Scholar]
15. Zheng J, Zhou Y, Li Y, Xu DP, Li S, Li HB. Spices for prevention and treatment of cancers. Nutrients. 2016;8:495. [PMC free article] [PubMed] [Google Scholar]
16. Xu DP, Zheng J, Zhou Y, Li Y, Li S, Li HB. Extraction of natural antioxidants from the Thelephora ganbajun mushroom by an ultrasound-assisted extraction technique and evaluation of antiproliferative activity of the extract against human cancer cells. Int J Mol Sci. 2016;17:1664. [PMC free article] [PubMed] [Google Scholar]
17. Zhang YJ, Gan RY, Li S, Zhou Y, Li AN, Xu DP, Li HB.
Antioxidant phytochemicals for the prevention and treatment of chronic diseases. Molecules. 2015;20:21138–21156. [PMC free article] [PubMed] [Google Scholar]
18. Li AN, Li S, Zhang YJ, Xu XR, Chen YM, Li HB. Resources and biological activities of natural polyphenols. Nutrients. 2014;6:6020–6047. [PMC free article] [PubMed] [Google Scholar]
19. Li F, Li S, Li HB, Deng GF, Ling WH, Wu S, Xu XR, Chen F. Antiproliferative activity of peels, pulps and seeds of 61 fruits. J Funct Foods. 2013;5:1298–1309. [Google Scholar]
20. Li F, Li S, Li HB, Deng GF, Ling WH, Xu XR. Antiproliferative activities of tea and herbal infusions. Food Funct. 2013;4:530–538. [PubMed] [Google Schola in r]
21. Xia EQ, Deng GF, Guo YJ, Li HB. Biological activities of polyphenols from grapes. Int J Mol Sci. 2010;11:622–646. [PMC free article] [PubMed] [Google Scholar]
22. Luchetti F, Canonico B, Betti M, Arcangeletti M, Pilolli F, Piroddi M, Canesi L, Papa S, Galli F. Melatonin signaling and cell protection function. Faseb J. 2010;24:3603–3624. [PubMed] [Google Scholar]
23. Vijayalaxmi Thomas CR, Reiter RJ, Herman TS. Melatonin: From basic research to cancer treatment clinics. J Clin Oncol. 2002;20:2575–2601. [PubMed] [Google Scholar]
24. Cutando A, Lopez-Valverde A, Arias-Santiago S, De Vicente J, De Diego RG. Role of melatonin in cancer treatment. Anticancer Res. 2012;32:2747–2753. [PubMed] [Google Scholar]
25. Srinivasan V, Spence DW, Pandi-Perumal SR, Trakht I, Cardinali DP. Therapeutic actions of melatonin in cancer: Possible mechanisms. Integr Cancer Ther. 2008;7:189–203. [PubMed] [Google Scholar]
26. Reppert SM. Melatonin receptors: Molecular biology of a new family of G protein-coupled receptors. J Biol Rhythm. 1997;12:528–531. [PubMed] [Google Scholar]
27. Deming SL, Lu W, Beeghly-Fadiel A, Zheng Y, Cai QY, Long JR, Shu XO, Gao YT, Zheng W. Melatonin pathway genes and breast cancer risk among Chinese women. Breast Cancer Res Tr. 2012;132:693–699. [PMC free article] [PubMed] [Google Scholar]
28. Jung B, Ahmad N. Melatonin in cancer management: Progress and promise. Cancer Res. 2006;66:9789–9793. [PubMed] [Google Scholar]
29. Sainz RM, Mayo JC, Rodriguez C, Tan DX, Lopez-Burillo S, Reiter RJ. Melatonin and cell death: Differential actions on apoptosis in normal and cancer cells. Cell Mol Life Sci. 2003;60:1407–1426. [PubMed] [Google Scholar]
30. Hill SM, Belancio VP, Dauchy RT, Xiang S, Brimer S, Mao L, Hauch A, Lundberg PW, Summers W, Yuan L, Frasch T, Blask DE. Melatonin: An inhibitor of breast cancer. Endocr Relat Cancer. 2015;22:R183–R204. [PMC free article] [PubMed] [Google Scholar]
31. Sanchez-Barcelo EJ, Mediavilla MD, Alonso-Gonzalez C, Reiter RJ. Melatonin uses in oncology: Breast cancer prevention and reduction of the side effects of chemotherapy and radiation. Expert Opin Inv Drug. 2012;21:819–831. [PubMed] [Google Scholar]
32. Yang WS, Deng Q, Fan WY, Wang WY, Wang X. Light exposure at night, sleep duration, melatonin, and breast cancer: A dose-response analysis of observational studies. Eur J Cancer Prev. 2014;23:269–276. [PubMed] [Google Scholar]
33. Abd El Moneim NA, El Masry H, Sorial MM. A molecular case-control study on the association of melatonin hormone and rs#10830963 single nucleotide polymorphism in its receptor MTNR1B gene with breast cancer. Middle East J cancer. 2015;6:11–20. [Google Scholar]
34. Basler M, Jetter A, Fink D, Seifert B, Kullak-Ublick GA, Trojan A. Urinary excretion of melatonin and association with breast cancer: Meta-Analysis and review of the literature. Breast Care. 2014;9:182–187. [PMC free article] [PubMed] [Google Scholar]
35. Schernhammer ES, Hankinson SE. Urinary melatonin levels and postmenopausal breast cancer risk in the nurses' health study cohort. Cancer Epidem Biomar. 2009;18:74–79. [PMC free article] [PubMed] [Google Scholar]
36. Travis RC, Allen DS, Fentiman IS, Key TJ. Melatonin and breast cancer: A prospective study. J Natl Cancer Inst. 2004;96:475–482. [PubMed] [Google Scholar]
37. Sturgeon SR, Doherty A, Reeves KW, Bigelow C, Stanczyk FZ, Ockene JK, Liu S, Manson JE, Neuhouser ML. Urinary levels of melatonin and risk of postmenopausal breast cancer: Women's health initiative observational cohort. Cancer Epidem Biomar. 2014;23:629–637. [PMC free article] [PubMed] [Google Scholar]
38. Brown SB, Hankinson SE, Eliassen AH, Reeves KW, Qian J, Arcaro KF, Wegrzyn LR, Willett WC, Schernhammer ES. Urinary melatonin concentration and the risk of breast cancer in nurses' health study II. Am J Epidemiol. 2015;181:155–162. [PMC free article] [PubMed] [Google Scholar]
39. Wang XS, Tipper S, Appleby PN, Allen NE, Key TJ, Travis RC. First-Morning urinary melatonin and breast cancer risk in the guernsey study. Am J Epidemiol. 2014;179:584–593. [PMC free article] [PubMed] [Google Scholar]
40. Sigurdardottir LG, Markt SC, Rider JR, Haneuse S, Fall K, Schernhammer ES, Tamimi RM, Flynn-Evans E, Batista JL, Launer L, Harris T, Aspelund T, Stampfer MJ, et al. Urinary melatonin levels, sleep disruption, and risk of prostate cancer in elderly men. Eur Urol. 2015;67:191–194. [PMC free article] [PubMed] [Google Scholar]
41. Tai S, Huang S, Bao B, Wu M. Urinary melatonin-sulfate/cortisol ratio and the presence of prostate cancer: A case-control study. Sci Rep. 2016;6:29606. [PMC free article] [PubMed] [Google Scholar]
42. Zhao M, Wan JY, Zeng K, Tong M, Lee AC, Ding JX, Chen Q. The reduction in circulating melatonin level may contribute to the pathogenesis of ovarian cancer: A retrospective study. J Cancer. 2016;7:831–836. [PMC free article] [PubMed] [Google Scholar]
43. Wang YM, Jin BZ, Ai F, Duan CH, Lu YZ, Dong TF, Fu QL. The efficacy and safety of melatonin in concurrent chemotherapy or radiotherapy for solid tumors: A meta-analysis of randomized controlled trials. Cancer Chemother Pharmacol. 2012;69:1213–1220. [PubMed] [Google Scholar]
44. Seely D, Wu P, Fritz H, Kennedy DA, Tsui T, Seely A, Mills E. Melatonin as adjuvant cancer care with and without chemotherapy: A systematic review and meta-analysis of randomized trials. Integr Cancer Ther. 2012;11:293–303. [PubMed] [Google Scholar]
45. Poole EM, Schernhammer E, Mills L, Hankinson SE, Tworoger SS. Urinary melatonin and risk of ovarian cancer. Cancer Causes Control. 2015;26:1501–1506. [PMC free article] [PubMed] [Google Scholar]
46. Parkin DM. International variation. Oncogene. 2004;23:6329–6340. [PubMed] [Google Scholar]
47. Mediavilla MD, Cos S, Sanchez-Barcelo EJ. Melatonin increases p53 and p21 WAF1 expression in MCF-7 human breast cancer cells in vitro. Life Sci. 1999;65:415–420. [PubMed] [Google Scholar]
48. Aubert C, Janiaud P, Lecalvez J. Effect of pinealectomy and melatonin on mammary tumor growth in SpragueeDawley rats under different conditions of lighting. J. Neural Transm. 1980;47:121–130. [PubMed] [Google Scholar]
49. Tamarkin L, Cohen M, Roselle D, Reichert C, Lippman M, Chabner B. Melatonin inhibition and pinealectomy enhancement of 7,12-dimethylbenz(a)anthracene-induced mammary tumors in the rat. Cancer Res. 1981;41:4432–4436. [PubMed] [Google Scholar]
50. Cos S, Mediavilla MD, Fernandez R, Gonzalez-Lamuno D, Sanchez-Barcelo EJ. Does melatonin induce apoptosis in MCF-7 human breast cancer cells in vitro? J Pineal Res. 2002;32:90–96. [PubMed] [Google Scholar]
51. Girgert R, Bartsch C, Hill SM, Kreienberg R, Hanf V. Tracking, the elusive antiestrogenic effect of melatonin: A new methodological approach. Neuroendocrinol Lett. 2003;24:440–444. [PubMed] [Google Scholar]
52. Martinez-Campa C, Alonso-Gonzalez C, Mediavilla MD, Cos S, Gonzalez A, Ramos S, Sanchez-Barcelo EJ. Melatonin inhibits both ER alpha activation and breast cancer cell proliferation induced by a metalloestrogen, cadmium. J Pineal Res. 2006;40:291–296. [PubMed] [Google Scholar]
53. Cos S, Martinez-Campa C, Mediavilla MD, Sanchez-Barcelo EJ. Melatonin modulates aromatase activity in MCF-7 human breast cancer cells. J Pineal Res. 2005;38:136–142. [PubMed] [Google Scholar]
54. Collins A, Yuan L, Kiefer TL, Cheng Q, Lai L, Hill SM. Overexpression of the MT1 melatonin receptor in MCF-7 human breast cancer cells inhibits mammary tumor formation in nude mice. Cancer Lett. 2003;189:49–57. [PubMed] [Google Scholar]
55. Lai L, Yuan L, Cheng Q, Dong CM, Mao LL, Hill SM. Alteration of the MT1 melatonin receptor gene and its expression in primary human breast tumors and breast cancer cell lines. Breast Cancer Res Treat. 2009;118:293–305. [PubMed] [Google Scholar]
56. Jardim-Perassi BV, Lourenco MR, Doho GM, Grigolo IH, Gelaleti GB, Ferreira LC, Borin TF, Moschetta MG, Zuccari D. Melatonin regulates angiogenic factors under hypoxia in breast cancer cell lines. Anticancer Agents Med Chem. 2016;16:347–358. [PubMed] [Google Scholar]
57. Goncalves ND, Colombo J, Lopes JR, Gelaleti GB, Moschetta MG, Sonehara NM, Hellmen E, Zanon CD, Oliani SM, Zuccari D. Effect of melatonin in epithelial mesenchymal transition markers and invasive properties of breast cancer stem cells of canine and human cell lines. PloS One. 2016;11:e0150407. [PMC free article] [PubMed] [Google Scholar]
58. Mao LL, Yuan L, Slakey LM, Jones FE, Burow ME, Hill SM. Inhibition of breast cancer cell invasion by melatonin is mediated through regulation of the p38 mitogen-activated protein kinase signaling pathway. Breast Cancer Res. 2010;12:R107. [PMC free article] [PubMed] [Google Scholar]
59. Lopes JR, Maschio LB, Jardim-Perassi BV, Moschetta MG, Ferreira LC, Martins GR, Gelaleti GB, Zuccari D. Evaluation of melatonin treatment in primary culture of canine mammary tumors. Oncol Rep. 2015;33:311–319. [PubMed] [Google Scholar]
60. Wang JS, Xiao XS, Zhang Y, Shi DB, Chen WB, Fu LY, Liu LQ, Xie FY, Kang TB, Huang WL, Deng WG. Simultaneous modulation of COX-2, p300, Akt, and Apaf-1 signaling by melatonin to inhibit proliferation and induce apoptosis in breast cancer cells. J Pineal Res. 2012;53:77–90. [PubMed] [Google Scholar]
61. Lissoni P, Rovelli F, Malugani F, Bucovec R, Conti A, Maestroni G. Anti-angiogenic activity of melatonin in advanced cancer patients. Neuroendocrinol Lett. 2001;22:45–47. [PubMed] [Google Scholar]
62. Alvarez-Garcia V, Gonzalez A, Alonso-Gonzalez C, Martinez-Campa C, Cos S. Regulation of vascular endothelial growth factor by melatonin in human breast cancer cells. J Pineal Res. 2013;54:373–380. [PubMed] [Google Scholar]
63. Zuccari D, Jardim BV, Lopes JR, Borin TF, Gelaleti GB, Moschetta MG, Leonel C, Ferreira LC, Maschio LB, Goncalves NN. Evaluation of hypoxia inducible factor 1-Alpha (HIF1) after treatment with melatonin in breast cancer cell line. Eur J Cancer. 2012;485:S254–S255. [Google Scholar]
64. Chottanapund S, Van Duursen M, Navasumrit P, Hunsonti P, Timtavorn S, Ruchirawat M, Van den Berg M. Anti-aromatase effect of resveratrol and melatonin on hormonal positive breast cancer cells co-cultured with breast adipose fibroblasts. Toxicol in Vitro. 2014;28:1215–1221. [PubMed] [Google Scholar]
65. Martinez-Campa C, Gonzalez A, Mediavilla MD, Alonso-Gonzalez C, Alvarez-Garcia V, Sanchez-Barcelo EJ, Cos S. Melatonin inhibits aromatase promoter expression by regulating cyclooxygenases expression and activity in breast cancer cells. Br J Cancer. 2009;101:1613–1619. [PMC free article] [PubMed] [Google Scholar]
66. Knower KC, To SQ, Takagi K, Miki Y, Sasano H, Simpson ER, Clyne CD. Melatonin suppresses aromatase expression and activity in breast cancer associated fibroblasts. Breast Cancer Res Treat. 2012;132:765–771. [PubMed] [Google Scholar]
67. Alvarez-Garcia V, Gonzalez A, Alonso-Gonzalez C, Martinez-Campa C, Cos S. Melatonin interferes in the desmoplastic reaction in breast cancer by regulating cytokine production. J Pineal Res. 2012;52:282–290. [PubMed] [Google Scholar]
68. Lee SE, Kim SJ, Yang H, Jeong SI, Hwang SY, Park CS, Park YS. Molecular analysis of melatonin-induced changes in breast cancer cells: Microarray study of anti-cancer effect of melatonin. Biochip J. 2011;5:353–361. [Google Scholar]
69. Lee SE, Kim SJ, Youn JP, Hwang SY, Park CS, Park YS. MicroRNA and gene expression analysis of melatonin-exposed human breast cancer cell lines indicating involvement of the anticancer effect. J Pineal Res. 2011;51:345–352. [PubMed] [Google Scholar]
70. Lee SE, Kim SJ, Yoon HJ, Yu SY, Yang H, Il Jeong S, Hwang SY, Park CS, Park YS. Genome-wide profiling in melatonin-exposed human breast cancer cell lines identifies differentially methylated genes involved in the anticancer effect of melatonin. J Pineal Res. 2013;54:80–88. [PubMed] [Google Scholar]
71. Mori F, Ferraiuolo M, Santoro R, Sacconi A, Goeman F, Pallocca M, Pulito C, Korita E, Fanciulli M, Muti P, Blandino G, Strano S. Multitargeting activity of miR-24 inhibits long-term melatonin anticancer effects. Oncotarget. 2016;7:20532–20548. doi: 10.18632/oncotarget.7978. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
72. Yuan L, Collins AR, Dai J, Dubocovich ML, Hill SM. MT1 melatonin receptor overexpression enhances the growth suppressive effect of melatonin in human breast cancer cells. Mol Cell Endocrinol. 2002;192:147–156. [PubMed] [Google Scholar]
73. Mao LL, Yuan L, Xiang SL, Zeringue SB, Dauchy RT, Blask DE, Hauch A, Hill SM. Molecular deficiency (ies) in MT1 melatonin signaling pathway underlies the melatonin- unresponsive phenotype in MDA- MB-231 human breast cancer cells. J Pineal Res. 2014;56:246–253. [PMC free article] [PubMed] [Google Scholar]
74. Kosar PA, Naziroglu M, Ovey IS, Cig B. Synergic effects of doxorubicin and melatonin on apoptosis and mitochondrial oxidative stress in MCF-7 breast cancer cells: Involvement of TRPV1 channels. J Membrane Biol. 2016;249:129–140. [PubMed] [Google Scholar]
75. Yun SM, Woo SH, Oh ST, Hong SE, Choe TB, Ye SK, Kim EK, Seong MK, Kim HA, Noh WC, Lee JK, Jin HO, Lee YH, et al. Melatonin enhances arsenic trioxide-induced cell death via sustained upregulation of Redd1 expression in breast cancer cells. Mol Cell Endocrinol. 2016;422:64–73. [PubMed] [Google Scholar]
76. Jung JH, Sohn EJ, Shin EA, Lee D, Kim B, Jung DB, Kim JH, Yun M, Lee HJ, Park YK, Kim SH. Melatonin suppresses the expression of 45S preribosomal RNA and upstream binding factor and enhances the antitumor activity of puromycin in MDA-MB-231 breast cancer cells. Evid Based Complement Alternat Med. 2013;2013:879746. [PMC free article] [PubMed] [Google Scholar]
77. Margheri M, Pacini N, Tani A, Nosi D, Squecco R, Dama A, Masala E, Francini F, Zecchi-Orlandini S, Formigli L. Combined effects of melatonin and all-trans retinoic acid and somatostatin on breast cancer cell proliferation and death: Molecular basis for the anticancer effect of these molecules. Eur J Pharmacol. 2012;681:34–43. [PubMed] [Google Scholar]
78. Proietti S, Cucina A, D'Anselmi F, Dinicola S, Pasqualato A, Lisi E, Bizzarri M. Melatonin and vitamin D-3 synergistically down-regulate Akt and MDM2 leading to TGF -1-dependent growth inhibition of breast cancer cells. J Pineal Res. 2011;50:150–158. [PubMed] [Google Scholar]
79. Alonso-Gonzalez C, Gonzalez A, Martinez-Campa C, Gomez-Arozamena J, Cos S. Melatonin sensitizes human breast cancer cells to ionizing radiation by downregulating proteins involved in double-strand DNA break repair. J Pineal Res. 2015;58:189–197. [PubMed] [Google Scholar]
80. Alonso-Gonzalez C, Gonzalez A, Martinez-Campa C, Menendez-Menendez J, Gomez-Arozamena J, Garcia-Vidal A, Cos S. Melatonin enhancement of the radiosensitivity of human breast cancer cells is associated with the modulation of proteins involved in estrogen biosynthesis. Cancer Lett. 2016;370:145–152. [PubMed] [Google Scholar]
81. Borin TF, Arbab AS, Gelaleti GB, Ferreira LC, Moschetta MG, Jardim-Perassi BV, Iskander A, Varma N, Shankar A, Coimbra VB, Fabri VA, de Oliveira JG, Zuccari D. Melatonin decreases breast cancer metastasis by modulating Rho-associated kinase protein-1 expression. J Pineal Res. 2016;60:3–15. [PMC free article] [PubMed] [Google Scholar]
82. Jardim-Perassi BV, Arbab AS, Ferreira LC, Borin TF, Varma N, Iskander A, Shankar A, Ali MM, Zuccari D. Effect of melatonin on tumor growth and angiogenesis in xenograft model of breast cancer. PloS One. 2014;9:e853111. [PMC free article] [PubMed] [Google Scholar]
83. Schwimmer H, Metzer A, Pilosof Y, Szyf M, Machnes ZM, Fares F, Harel O, Haim A. Light at night and melatonin have opposite effects on breast cancer tumors in mice assessed by growth rates and global DNA methylation. Chronobiol Int. 2014;31:144–150. [PubMed] [Google Scholar]
84. Mao LL, Dauchy RT, Blask DE, Slakey LM, Xiang SL, Yuan L, Dauchy EM, Shan B, Brainard GC, Hanifin JP, Frasch T, Duplessis TT, Hill SM. Circadian gating of Epithelial-to-Mesenchymal transition in breast cancer cells via Melatonin-Regulation of GSK3. Mol Endocrinol. 2012;26:1808–1820. [PMC free article] [PubMed] [Google Scholar]
85. Kassayova M, Bobrov N, Strojny L, Orendas P, Demeckova V, Jendzelovsky R, Kubatka P, Kiskova T, Kruzliak P, Adamkov M, Bomba A, Fedorocko P. Anticancer and immunomodulatory effects of lactobacillus plantarum LS/07, inulin and melatonin in NMU-induced rat model of breast cancer. Anticancer Res. 2016;36:2719–2728. [PubMed] [Google Scholar]
86. Talib WH, Saleh S. Propionibacterium acnes augments antitumor, anti-angiogenesis and immunomodulatory effects of melatonin on breast cancer implanted in mice. PloS One. 2015;10:e01243844. [PMC free article] [PubMed] [Google Scholar]
87. Ma C, Li LX, Zhang Y, Xiang C, Ma T, Ma ZQ, Zhang ZP. Protective and sensitive effects of melatonin combined with adriamycin on ER plus (estrogen receptor) breast cancer. Eur J Gynaecol Oncol. 2015;36:197–202. [PubMed] [Google Scholar]
88. Orendas P, Kubatka P, Bojkova B, Kassayova M, Kajo K, Vybohova D, Kruzliak P, Pec M, Adamkov M, Kapinova A, Adamicova K, Sadlonova V, Chmelova M, et al. Melatonin potentiates the anti-tumour effect of pravastatin in rat mammary gland carcinoma model. Int J Exp Pathol. 2014;95:401–410. [PMC free article] [PubMed] [Google Scholar]
89. Xiang SL, Dauchy RT, Hauch A, Mao LL, Yuan L, Wren MA, Belancio VP, Mondal D, Frasch T, Blask DE, Hill SM. Doxorubicin resistance in breast cancer is driven by light at night-induced disruption of the circadian melatonin signal. J Pineal Res. 2015;59:60–69. [PMC free article] [PubMed] [Google Scholar]
90. Dauchy RT, Xiang SL, Mao LL, Brimer S, Wren MA, Yuan L, Anbalagan M, Hauch A, Frasch T, Rowan BG, Blask DE, Hill SM. Circadian and melatonin disruption by exposure to light at night drives intrinsic resistance to tamoxifen therapy in breast cancer. Cancer Res. 2014;74:4099–4110. [PMC free article] [PubMed] [Google Scholar]
91. Wong MCS, Goggins WB, Wang HHX, Fung FDH, Leung C, Wong SYS, Ng CF, Sung JJY. Global incidence and mortality for prostate cancer: Analysis of temporal patterns and trends in 36 countries. Eur Urol. 2016;70:862–874. [PubMed] [Google Scholar]
92. Sainz RM, Mayo JC, Tan DX, Leon J, Manchester L, Reiter RJ. Melatonin reduces prostate cancer cell growth leading to neuroendocrine differentiation via a receptor and PKA independent mechanism. Prostate. 2005;63:29–43. [PubMed] [Google Scholar]
93. Sohn EJ, Won G, Lee J, Lee S, Kim SH. Upregulation of miRNA3195 and miRNA374b mediates the Anti-Angiogenic properties of melatonin in hypoxic PC-3 prostate cancer cells. J Cancer. 2015;6:19–28. [PMC free article] [PubMed] [Google Scholar]
94. Tam CW, Shiu S. Functional interplay between melatonin receptor-mediated antiproliferative signaling and androgen receptor signaling in human prostate epithelial cells: Potential implications for therapeutic strategies against prostate cancer. J Pineal Res. 2011;51:297–312. [PubMed] [Google Scholar]
95. Shiu S, Leung WY, Tam CW, Liu V, Yao KM. Melatonin MT1 receptor-induced transcriptional up-regulation of p27(Kip1) in prostate cancer antiproliferation is mediated via inhibition of constitutively active nuclear factor kappa B (NF-B): Potential implications on prostate cancer chemoprevention and therapy. J Pineal Res. 2013;54:69–79. [PubMed] [Google Scholar]
96. Cho SY, Lee HJ, Jeong SJ, Lee HJ, Kim HS, Chen CY, Lee EO, Kim SH. Sphingosine kinase 1 pathway is involved in melatonin-induced HIF-1 alpha inactivation in hypoxic PC-3 prostate cancer cells. J Pineal Res. 2011;51:87–93. [PubMed] [Google Scholar]
97. Jung-Hynes B, Nihal M, Zhong W, Ahmad N. Role of sirtuin histone deacetylase SIRT1 in prostate cancer: A target for prostate cancer management via its inhibition? J Biol Chem. 2009;284:3823–3832. [PMC free article] [PubMed] [Google Scholar]
98. Jung-Hynes B, Schmit TL, Reagan-Shaw SR, Siddiqui IA, Mukhtar H, Ahmad N. Melatonin, a novel Sirt1 inhibitor, imparts antiproliferative effects against prostate cancer in vitro in culture and in vivo in TRAMP model. J Pineal Res. 2011;50:140–149. [PMC free article] [PubMed] [Google Scholar]
99. Rodriguez-Garcia A, Mayo JC, Hevia D, Quiros-Gonzalez I, Navarro M, Sainz RM. Phenotypic changes caused by melatonin increased sensitivity of prostate cancer cells to cytokine-induced apoptosis. J Pineal Res. 2013;54:33–45. [PubMed] [Google Scholar]
100. Jung-Hynes B, Huang W, Reiter RJ, Ahmad N. Melatonin resynchronizes dysregulated circadian rhythm circuitry in human prostate cancer cells. J Pineal Res. 2010;49:60–68. [PMC free article] [PubMed] [Google Scholar]
101. Dauchy RT, Hoffman AE, Wren-Dail MA, Hanifin JP, Warfield B, Brainard GC, Xiang S, Yuan L, Hill SM, Belancio VP, Dauchy EM, Smith K, Blask DE. Daytime blue light enhances the nighttime circadian melatonin inhibition of human prostate cancer growth. Comparative Med. 2015;65:473–485. [PMC free article] [PubMed] [Google Scholar]
102. Paroni R, Terraneo L, Bonomini F, Finati E, Virgili E, Bianciardi P, Favero G, Fraschini F, Reiter RJ, Rezzani R, Samaja M. Antitumour activity of melatonin in a mouse model of human prostate cancer: Relationship with hypoxia signalling. J Pineal Res. 2014;57:43–52. [PubMed] [Google Scholar]
103. Dauchy RT, Cecil KS, Dauchy EM, Hanifin JP, Mao LL, Slakey LM, Belancio VP, Hill SM, Brainard GC, Blask DE. Melatonin-depleted blood from healthy adult men exposed to environmental light at night stimulates growth, signal transduction and metabolic activity of tissue-isolated human prostate cancer xenografts in nude rats. Cancer Res. 2011;71:1324. [Google Scholar]
104. Jablonska K, Pula B, Zemla A, Kobierzycki C, Kedzia W, Nowak-Markwitz E, Spaczynski M, Zabel M, Podhorska-Okolow M, Dziegiel P. Expression of the MT1 melatonin receptor in ovarian cancer cells. Int J Mol Sci. 2014;15:23074–23089. [PMC free article] [PubMed] [Google Scholar]
105. Koshiyama M, Matsumura N, Konishi I. Recent concepts of ovarian carcinogenesis: Type i and type II. Biomed Res Int. 2014;2014:1–11. [PMC free article] [PubMed] [Google Scholar]
106. Shen CJ, Chang CC, Chen YT, Lai CS, Hsu YC. Melatonin suppresses the growth of ovarian cancer cell lines (OVCAR-429 and PA-1) and potentiates the effect of g1 arrest by targeting CDKs. Int J Mol Sci. 2016;17:176. [PMC free article] [PubMed] [Google Scholar]
107. Kim JH, Jeong SJ, Kim B, Yun SM, Choi DY, Kim SH. Melatonin synergistically enhances cisplatin-induced apoptosis via the dephosphorylation of ERK/p90 ribosomal S6 kinase/heat shock protein 27 in SK-OV-3 cells. J Pineal Res. 2012;52:244–252. [PubMed] [Google Scholar]
108. Chuffa L, Fioruci-Fontanelli BA, Mendes LO, Favaro WJ, Pinheiro P, Martinez M, Martinez FE. Characterization of chemically induced ovarian carcinomas in an Ethanol-Preferring rat model: Influence of Long-Term melatonin treatment. PloS One. 2013;8:e8167612. [PMC free article] [PubMed] [Google Scholar]
109. Chuffa L, Alves MS, Martinez M, Camargo I, Pinheiro P, Domeniconi RF, Junior L, Martinez FE. Apoptosis is triggered by melatonin in an in vivo model of ovarian carcinoma. Endocr Relat Cancer. 2016;23:65–76. [PubMed] [Google Scholar]
110. Chuffa L, Fioruci-Fontanelli BA, Mendes LO, Seiva F, Martinez M, Favaro WJ, Domeniconi RF, Pinheiro P, Dos Santos LD, Martinez FE. Melatonin attenuates the TLR4-mediated inflammatory response through MyD88-and TRIF-dependent signaling pathways in an in vivo model of ovarian cancer. BMC Cancer. 2015;15:34. [PMC free article] [PubMed] [Google Scholar]
111. Sheng Q, Liu J. The therapeutic potential of targeting the EGFR family in epithelial ovarian cancer. Brit J Cancer. 2011;104:1241–1245. [PMC free article] [PubMed] [Google Scholar]
112. Ferreira GM, Martinez M, Camargo I, Domeniconi RF, Martinez FE, Chuffa L. Melatonin attenuates her-2, p38 MAPK, p-AKT, and mTOR levels in ovarian carcinoma of Ethanol-Preferring rats. J Cancer. 2014;5:728–735. [PMC free article] [PubMed] [Google Scholar]
113. Scarinci IC, Garcia FAR, Kobetz E, Partridge EE, Brandt HM, Bell MC, Dignan M, Ma GX, Daye JL, Castle PE. Cervical cancer prevention. Cancer. 2010;116:2531–2542. [PMC free article] [PubMed] [Google Scholar]
114. Pariente R, Pariente JA, Rodriguez AB, Espino J. Melatonin sensitizes human cervical cancer HeLa cells to cisplatin-induced cytotoxicity and apoptosis: Effects on oxidative stress and DNA fragmentation. J Pineal Res. 2016;60:55–64. [PubMed] [Google Scholar]
115. Dauchy RT, Dauchy EM, Mao LL, Wren MA, Belancio VP, Hill SM, Blask DE. The circadian neurohormone melatonin inhibits aerobic glycolysis (Warburg effect) and fatty acid metabolic signaling in human colorectal and cervical cancer. Cancer Res. 2013;73:4001. [Google Scholar]
116. Dauchy RT, Dauchy EM, Belancio VP, Mao LL, Hill SM, Sauer LA, Blask DE. Melatonin inhibition of linoleic acid transport and 13-HODE production in HeLa human cervical adenocarcinoma occurs via receptor-mediated signal transduction. Cancer Res. 2012;72:5167. [Google Scholar]
117. McAlpine JN, Temkin SM, Mackay HJ. Endometrial cancer: Not your grandmother's cancer. Cancer. 2016;122:2787–2798. [PubMed] [Google Scholar]
118. Kanishi Y, Kobayashi Y, Noda S, Ishizuka B, Saito K. Differential growth inhibitory effect of melatonin on two endometrial cancer cell lines. J Pineal Res. 2000;28:227–233. [PubMed] [Google Scholar]
119. Ciortea R, Costin N, Braicu I, Haragas D, Hudacsko A, Bondor C, Mihu D, Mihu CM. Effect of melatonin on intra-abdominal fat in correlation with endometrial proliferation in ovariectomized rats. Anticancer Res. 2011;31:2637–2643. [PubMed] [Google Scholar]
120. Warnakulasuriya S. Global epidemiology of oral and oropharyngeal cancer. Oral Oncol. 2009;45:309–316. [PubMed] [Google Scholar]
121. Yeh CM, Lin CW, Yang JS, Yang WE, Su SC, Yang SF. Melatonin inhibits TPA-induced oral cancer cell migration by suppressing matrix metalloproteinase-9 activation through the histone acetylation. Oncotarget. 2016;7:21952–21967. doi: 10.18632/oncotarget.8009. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
122. Goncalves ND, Rodrigues RV, Jardim-Perassi BV, Moschetta MG, Lopes JR, Colombo J, Zuccari D. Molecular markers of angiogenesis and metastasis in lines of oral carcinoma after treatment with melatonin. Anticancer Agents Med Chem. 2014;14:1302–1311. [PubMed] [Google Scholar]
123. D'Alessandro LA, Meyer R, Klingmüller U. Hepatocellular carcinoma: A systems biology perspective. Front Physiol. 2013;4:28. [PMC free article] [PubMed] [Google Scholar]
124. Zhou Y, Li Y, Zhou T, Zheng J, Li S, Li H. Dietary natural products for prevention and treatment of liver cancer. Nutrients. 2016;8:156. [PMC free article] [PubMed] [Google Scholar]
125. Kapitanov T, Neumann UP, Schmeding M. Hepatocellular carcinoma in liver cirrhosis: Surgical resection versus transarterial chemoembolization—a Meta-Analysis. Gastroent Res Pract. 2015;2015:1–8. [PMC free article] [PubMed] [Google Scholar]
126. Ordonez R, Carbajo-Pescador S, Prieto-Dominguez N, Garcia-Palomo A, Gonzalez-Gallego J, Mauriz JL. Inhibition of matrix metalloproteinase-9 and nuclear factor kappa B contribute to melatonin prevention of motility and invasiveness in HepG2 liver cancer cells. J Pineal Res. 2014;56:20–30. [PubMed] [Google Scholar]
127. Carbajo-Pescador S, Ordonez R, Benet M, Jover R, Garcia-Palomo A, Mauriz JL, Gonzalez-Gallego J. Inhibition of VEGF expression through blockade of Hif1 alpha and STAT3 signaling mediates the anti-angiogenic effect of melatonin in HepG2 liver cancer cells. Brit J Cancer. 2013;109:83–91. [PMC free article] [PubMed] [Google Scholar]
128. Fan LL, Sun GP, Ma T, Zhong F, Wei W. Melatonin overcomes apoptosis resistance in human hepatocellular carcinoma by targeting Survivin and XIAP. J Pineal Res. 2013;55:174–183. [PubMed] [Google Scholar]
129. Carbajo-Pescador S, Steinmetz C, Kashyap A, Lorenz S, Mauriz JL, Heise M, Galle PR, Gonzalez-Gallego J, Strand S. Melatonin induces transcriptional regulation of Bim by FoxO3a in HepG2 cells. Brit J Cancer. 2013;108:442–449. [PMC free article] [PubMed] [Google Scholar]
130. Carbajo-Pescador S, Garcia-Palomo A, Martin-Renedo J, Piva M, Gonzalez-Gallego J, Mauriz JL. Melatonin modulation of intracellular signaling pathways in hepatocarcinoma HepG2 cell line: Role of the MT1 receptor. J Pineal Res. 2011;51:463–471. [PubMed] [Google Scholar]
131. Zha LX, Fan LL, Sun GP, Wang H, Ma T, Zhong F, Wei W. Melatonin sensitizes human hepatoma cells to endoplasmic reticulum stress-induced apoptosis. J Pineal Res. 2012;52:322–331. [PubMed] [Google Scholar]
132. Verma D, Hashim OH, Jayapalan JJ, Subramanian P. Effect of melatonin on antioxidant status and circadian activity rhythm during hepatocarcinogenesis in mice. J Cancer Res Ther. 2014;10:1040–1044. [PubMed] [Google Scholar]
133. Moreira AJ, Ordonez R, Cerski CT, Picada JN, Garcia-Palomo A, Marroni NP, Mauriz JL, Gonzalez-Gallego J. Melatonin activates endoplasmic reticulum stress and apoptosis in rats with diethylnitrosamine-induced hepatocarcinogenesis. PloS One. 2015;10:e014451712. [PMC free article] [PubMed] [Google Scholar]
134. Compérat E, Camparo P. Histological classification of malignant renal tumours at a time of major diagnostic and therapeutic changes. Diagn Interv Imaging. 2012;93:221–231. [PubMed] [Google Scholar]
135. Lin Y, Lee L, Lee W, Chu C, Tan P, Yang Y, Chen W, Yang S, Hsiao M, Chien M. Melatonin inhibits MMP-9 transactivation and renal cell carcinoma metastasis by suppressing Akt-MAPKs pathway and NF-B DNA-binding activity. J Pineal Res. 2016;60:277–290. [PubMed] [Google Scholar]
136. Park EJ, Woo SM, Min KJ, Kwon TK. Transcriptional and post-translational regulation of Bim controls apoptosis in melatonin-treated human renal cancer Caki cells. J Pineal Res. 2014;56:97–106. [PubMed] [Google Scholar]
137. Min KJ, Kim HS, Park EJ, Kwon TK. Melatonin enhances thapsigargin-induced apoptosis through reactive oxygen species-mediated upregulation of CCAAT-enhancer-binding protein homologous protein in human renal cancer cells. J Pineal Res. 2012;53:99–106. [PubMed] [Google Scholar]
138. Um HJ, Park JW, Kwon TK. Melatonin sensitizes Caki renal cancer cells to kahweol-induced apoptosis through CHOP-mediated up-regulation of PUMA. J Pineal Res. 2011;50:359–366. [PubMed] [Google Scholar]
139. Costa G, Thuler LCS, Ferreira CG. Epidemiological changes in the histological subtypes of 35,018 non-small-cell lung cancer cases in Brazil. Lung Cancer. 2016;97:66–72. [PubMed] [Google Scholar]
140. Lu JJ, Fu LY, Tang ZP, Zhang CL, Qin LJ, Wang JS, Yu ZL, Shi DB, Xiao XS, Xie FY, Huang WL, Deng WG. Melatonin inhibits AP-2 /hTERT, NF-B/COX-2 and Akt/ERK and activates caspase/Cyto C signaling to enhance the antitumor activity of berberine in lung cancer cells. Oncotarget. 2016;7:2985–3001. doi: 10.18632/oncotarget.6407. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
141. Ma ZQ, Yang Y, Fan CX, Han J, Wang DJ, Di SY, Hu W, Liu D, Li XF, Reiter RJ, Yan XL. Melatonin as a potential anticarcinogen for non-small-cell lung cancer. Oncotarget. 2016;7:46768–46784. doi: 10.18632/oncotarget.8776. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
142. Kim W, Jeong JW, Kim JE. CCAR2 deficiency augments genotoxic stress-induced apoptosis in the presence of melatonin in non-small cell lung cancer cells. Tumor Biol. 2014;35:10919–10929. [PubMed] [Google Scholar]
143. Zhou QY, Gui SY, Zhou Q, Wang Y. Melatonin inhibits the migration of human lung adenocarcinoma a549 cell lines involving JNK/MAPK pathway. PloS One. 2014;9:e1011327. [PMC free article] [PubMed] [Google Scholar]
144. Yun M, Kim EO, Lee D, Kim JH, Kim J, Lee H, Lee J, Kim SH. Melatonin sensitizes h1975 Non-Small-Cell lung cancer cells harboring a T790M-Targeted epidermal growth factor receptor mutation to the tyrosine kinase inhibitor gefitinib. Cell Physiol Biochem. 2014;34:865–872. [PubMed] [Google Scholar]
145. Crew KD, Neugut AI. Epidemiology of gastric cancer. World J Gastroentero. 2006;12:354–362. [PMC free article] [PubMed] [Google Scholar]
146. Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. 2015;65:87–108. [PubMed] [Google Scholar]
147. Wang RX, Liu H, Xu L, Zhang H, Zhou RX. Involvement of nuclear receptor RZR/ROR gamma in melatonin-induced HIF-1 alpha inactivation in SGC-7901 human gastric cancer cells. Oncol Rep. 2015;34:2541–2546. [PubMed] [Google Scholar]
148. Zhou RX, Wang RX, Song J, Zhang H, Luo JH, Liu H. Melatonin inhibit the angiogenesis of gastric cancer by nuclear receptor. Faseb J. 2015:291. [Google Scholar]
149. Li WM, Fan MD, Chen YN, Zhao Q, Song CY, Yan Y, Jin Y, Huang ZM, Lin CJ, Wu JS. Melatonin induces cell apoptosis in AGS cells through the activation of JNK and p38 MAPK and the suppression of nuclear Factor-Kappa b: A novel therapeutic implication for gastric cancer. Cell Physiol Biochem. 2015;37:2323–2338. [PubMed] [Google Scholar]
150. Zhang S, Qi Y, Zhang H, He W, Zhou Q, Gui S, Wang Y. Melatonin inhibits cell growth and migration, but promotes apoptosis in gastric cancer cell line, SGC7901. Biotech Histochem. 2013;88:281–289. [PubMed] [Google Scholar]
151. Xu L, Liu H, Zhang H, Wang RX, Song J, Zhou RX. Growth-Inhibitory activity of melatonin on murine foregastric carcinoma cells in vitro and the underlying molecular mechanism. Anat Rec. 2013;296:914–920. [PubMed] [Google Scholar]
152. Liu H, Xu L, Wei JE, Xie MR, Wang SE, Zhou RX. Role of CD4+CD25+ regulatory t cells in Melatonin-Mediated inhibition of murine gastric cancer cell growth in vivo and in vitro. Anat Rec (Hoboken) 2011;294:781–788. [PubMed] [Google Scholar]
153. Zhang SM, Zuo L, Gui SY, Zhou Q, Wei W, Wang Y. Induction of cell differentiation and promotion of endocan gene expression in stomach cancer by melatonin. Mol Biol Rep. 2012;39:2843–2849. [PubMed] [Google Scholar]
154. Wu SM, Lin WY, Shen CC, Pan HC, Keh-Bin W, Chen YC, Jan YJ, Lai DW, Tang SC, Tien HR, Chiu CS, Tsai TC, Lai YL, et al. Melatonin set out to ER stress signaling thwarts epithelial mesenchymal transition and peritoneal dissemination via calpain-mediated C/EBP and NFB cleavage. J Pineal Res. 2016;60:142–154. [PubMed] [Google Scholar]
155. Leja-Szpak A, Jaworek J, Pierzchalski P, Reiter RJ. Melatonin induces pro-apoptotic signaling pathway in human pancreatic carcinoma cells (PANC-1) J Pineal Res. 2010;49:248–255. [PubMed] [Google Scholar]
156. Han SS, Jang JY, Kim SW, Kim WH, Lee KU, Park YH. Analysis of long-term survivors after surgical resection for pancreatic cancer. Pancreas. 2006;32:271–275. [PubMed] [Google Scholar]
157. Talar-Wojnarowska R, Malecka-Panas E. Molecular pathogenesis of pancreatic adenocarcinoma: Potential clinical implications. Med Sci Monitor. 2006;12:RA186–RA193. [PubMed] [Google Scholar]
158. Lv D, Cui PL, Yao SW, Xu YQ, Yang ZX. Melatonin inhibits the expression of vascular endothelial growth factor in pancreatic cancer cells. Chinese J Cancer Res. 2012;24:310–316. [PMC free article] [PubMed] [Google Scholar]
159. Gonzalez A, Del Castillo-Vaquero A, Miro-Moran A, Tapia JA, Salido GM. Melatonin reduces pancreatic tumor cell viability by altering mitochondrial physiology. J Pineal Res. 2011;50:250–260. [PubMed] [Google Scholar]
160. Xu CF, Wu AR, Zhu H, Fang HY, Xu LL, Ye JX, Shen JQ. Melatonin is involved in the apoptosis and necrosis of pancreatic cancer cell line SW-1990 via modulating of Bcl-2/Bax balance. Biomed Pharmacother. 2013;67:133–139. [PubMed] [Google Scholar]
161. Uguz AC, Cig B, Espino J, Bejarano I, Naziroglu M, Rodriguez AB, Pariente JA. Melatonin potentiates chemotherapy-induced cytotoxicity and apoptosis in rat pancreatic tumor cells. J Pineal Res. 2012;53:91–98. [PubMed] [Google Scholar]
162. Ruiz-Rabelo J, Vazquez R, Arjona A, Perea D, Montilla P, Tunez I, Muntane J, Padillo J. Improvement of capecitabine antitumoral activity by melatonin in pancreatic cancer. Pancreas. 2011;40:410–414. [PubMed] [Google Scholar]
163. Lea A, Allingham-Hawkins D, Levine S. BRAF p.Val600Glu (V600E) testing for assessment of treatment options in metastatic colorectal cancer. PLoS Curr. 2010;2:RRN1187. [PMC free article] [PubMed] [Google Scholar]
164. Buldak RJ, Pilc-Gumula K, Buldak L, Witkowska D, Kukla M, Polaniak R, Zwirska-Korczala K. Effects of ghrelin, leptin and melatonin on the levels of reactive oxygen species, antioxidant enzyme activity and viability of the HCT 116 human colorectal carcinoma cell line. Mol Med Rep. 2015;12:2275–2282. [PubMed] [Google Scholar]
165. Garcia-Navarro A, Gonzalez-Puga C, Escames G, Lopez LC, Lopez A, Lopez-Cantarero M, Camacho E, Espinosa A, Gallo MA, Acuna-Castroviejo D. Cellular mechanisms involved in the melatonin inhibition of HT-29 human colon cancer cell proliferation in culture. J Pineal Res. 2007;43:195–205. [PubMed] [Google Scholar]
166. Wei JY, Li WM, Zhou LL, Lu QN, He W. Melatonin induces apoptosis of colorectal cancer cells through HDAC4 nuclear import mediated by CaMKII inactivation. J Pineal Res. 2015;58:429–438. [PubMed] [Google Scholar]
167. Rosanò L, Spinella F, Bagnato A. Endothelin 1 in cancer: Biological implications and therapeutic opportunities. Nat Rev Cancer. 2013;13:637–651. [PubMed] [Google Scholar]
168. Leon J, Casado J, Ruiz S, Zurita MS, Gonzalez-Puga C, Rejon JD, Gila A, de Rueda PM, Pavon EJ, Reiter RJ, Ruiz-Extremera A, Salmeron J. Melatonin reduces endothelin-1 expression and secretion in colon cancer cells through the inactivation of FoxO-1 and NF- B. J Pineal Res. 2014;56:415–426. [PubMed] [Google Scholar]
169. Batista A, Da Silva TG, Teixeira A, de Medeiros PL, Teixeira VW, Alves LC, Dos Santos F, Silva EC. Ultrastructural aspects of melatonin cytotoxicity on Caco-2 cells in vitro. Micron. 2014;59:17–23. [PubMed] [Google Scholar]
170. Hong Y, Won J, Lee Y, Lee S, Park K, Chang KT, Hong Y. Melatonin treatment induces interplay of apoptosis, autophagy, and senescence in human colorectal cancer cells. J Pineal Res. 2014;56:264–274. [PubMed] [Google Scholar]
171. Nemeth C, Humpeler S, Kallay E, Mesteri I, Svoboda M, Rogelsperger O, Klammer N, Thalhammer T, Ekmekcioglu C. Decreased expression of the melatonin receptor 1 in human colorectal adenocarcinomas. J Biol Regul Homeost Agents. 2011;25:531–542. [PubMed] [Google Scholar]
172. Wang JS, Guo W, Chen WB, Yu WD, Tian Y, Fu LY, Shi DB, Tong B, Xiao XS, Huang WL, Deng WG. Melatonin potentiates the antiproliferative and pro-apoptotic effects of ursolic acid in colon cancer cells by modulating multiple signaling pathways. J Pineal Res. 2013;54:406–416. [PubMed] [Google Scholar]
173. Trivedi PP, Jena GB, Tikoo KB, Kumar V. Melatonin modulated autophagy and Nrf2 signaling pathways in mice with colitis-associated colon carcinogenesis. Mol Carcinogen. 2016;55:255–267. [PubMed] [Google Scholar]
174. Anisimov VN, Kvetnoy IM, Chumakova NK, Kvetnaya TV, Molotkov AO, Pogudina NA, Popovich IG, Popuchiev VV, Zabezhinski MA, Bartsch H, Bartsch C. Melatonin and colon carcinogenesis. II. Intestinal melatonin-containing cells and serum melatonin level in rats with 1,2-dimethylhydrazine-induced colon tumors. Exp Toxicol Pathol. 1999;51:47–52. [PubMed] [Google Scholar]
175. Kannen V, Marini T, Zanette DL, Frajacomo FT, Silva G, Silva WA, Garcia SB. The melatonin action on stromal stem cells within pericryptal area in colon cancer model under constant light. Biochem Bioph Res Co. 2011;405:593–598. [PubMed] [Google Scholar]
176. Kim HS, Kim TJ, Yoo YM. Melatonin combined with endoplasmic reticulum stress induces cell death via the PI3K/Akt/mTOR pathway in B16F10 melanoma cells. PloS One. 2014;9:e926273. [PMC free article] [PubMed] [Google Scholar]
177. Yi CH, Zhang Y, Yu ZL, Xiao Y, Wang JS, Qiu HJ, Yu WD, Tang RR, Yuan YH, Guo W, Deng WG. Melatonin enhances the anti-tumor effect of fisetin by inhibiting COX-2/iNOS and NF-B/p300 signaling pathways. PloS One. 2014;9:e999437. [PMC free article] [PubMed] [Google Scholar]
178. Bonmati-Carrion MA, Alvarez-Sanchez N, Hardeland R, Madrid JA, Rol MA. A comparison of b16 melanoma cells and 3T3 fibroblasts concerning cell viability and ROS production in the presence of melatonin, tested over a wide range of concentrations. Int J Mol Sci. 2013;14:3901–3920. [PMC free article] [PubMed] [Google Scholar]
179. Wang BQ, Yang QH, Xu RK, Xu JN. Elevated levels of mitochonrial respiratory complexes activities and ATP production in 17—estradiol-induced prolactin-secretory tumor cells in male rats are inhibited by melatonin in vivo and in vitro. Chin Med J (Engl) 2013;126:4724–4730. [PubMed] [Google Scholar]
180. Mao LL, Dauchy RT, Blask DE, Dauchy EM, Slakey LM, Brimer S, Yuan L, Xiang SL, Hauch A, Smith K, Frasch T, Belancio VP, Wren MA, et al. Melatonin suppression of aerobic glycolysis (Warburg effect), survival signalling and metastasis in human leiomyosarcoma. J Pineal Res. 2016;60:167–177. [PubMed] [Google Scholar]
181. Burattini S, Battistelli M, Codenotti S, Falcieri E, Fanzani A, Salucci S. Melatonin action in tumor skeletal muscle cells: An ultrastructural study. Acta Histochem. 2016;118:278–285. [PubMed] [Google Scholar]
182. Batista APC, Da Silva TG, Teixeira AAC, de Medeiros PL, Teixeira VW, Alves LC, Dos Santos FAB. Melatonin effect on the ultrastructure of Ehrlich ascites tumor cells, lifetime and histopathology in Swiss mice. Life Sci. 2013;93:882–888. [PubMed] [Google Scholar]
183. Delgado J, Terron M, Garcia-Martinez V, Lopez-Sanchez C, Barriga C, Pariente JA, Rodriguez AB. Oral melatonin administration and programmed cell death of neutrophils, lymphocytes, and other cell types from rats injected with HL-60 cells. J Appl Biomed. 2011;9:197–207. [Google Scholar]
184. Casado-Zapico S, Martin V, Garcia-Santos G, Rodriguez-Blanco J, Sanchez-Sanchez AM, Luno E, Suarez C, Garcia-Pedrero JM, Menendez ST, Antolin I, Rodriguez C. Regulation of the expression of death receptors and their ligands by melatonin in haematological cancer cell lines and in leukaemia cells from patients. J Pineal Res. 2011;50:345–355. [PubMed] [Google Scholar]
185. Sanchez-Sanchez AM, Martin V, Garcia-Santos G, Rodriguez-Blanco J, Casado-Zapico S, Suarez-Garnacho S, Antolin I, Rodriguez C. Intracellular redox state as determinant for melatonin antiproliferative vs cytotoxic effects in cancer cells. Free Radical Res. 2011;45:1333–1341. [PubMed] [Google Scholar]
186. Martín V, Sanchez-Sanchez AM, Herrera F, Gomez-Manzano C, Fueyo J, Alvarez-Vega MA, Antolín I, Rodriguez C. Melatonin-induced methylation of the ABCG2/BCRP promoter as a novel mechanism to overcome multidrug resistance in brain tumour stem cells. Br J Cancer. 2013;108:2005–2012. [PMC free article] [PubMed] [Google Scholar]
187. Casado-Zapico S, Rodriguez-Blanco J, Garcia-Santos G, Martin V, Sanchez-Sanchez AM, Antolin I, Rodriguez C. Synergistic antitumor effect of melatonin with several chemotherapeutic drugs on human Ewing sarcoma cancer cells: Potentiation of the extrinsic apoptotic pathway. J Pineal Res. 2010;48:72–80. [PubMed] [Google Scholar]
188. Barni S, Lissoni P, Cazzaniga M, Ardizzoia A, Meregalli S, Fossati V, Fumagalli L, Brivio F, Tancini G. A randomized study of low-dose subcutaneous interleukin-2 plus melatonin versus supportive care alone in metastatic colorectal cancer patients progressing under 5-fluorouracil and folates. Oncology. 1995;52:243–245. [PubMed] [Google Scholar]
189. Lissoni P, Barni S, Meregalli S, Fossati V, Cazzaniga M, Esposti D, Tancini G. Modulation of cancer endocrine therapy by melatonin: A phase II study of tamoxifen plus melatonin in metastatic breast cancer patients progressing under tamoxifen alone. Br J Cancer. 1995;71:854–6. [PMC free article] [PubMed] [Google Scholar]
190. Lissoni P, Barni S, Mandala M, Ardizzoia A, Paolorossi F, Vaghi M, Longarini R, Malugani F, Tancini G. Decreased toxicity and increased efficacy of cancer chemotherapy using the pineal hormone melatonin in metastatic solid tumour patients with poor clinical status. Eur J Cancer. 1999;35:1688–1692. [PubMed] [Google Scholar]
191. Lissoni P, Chilelli M, Villa S, Cerizza L, Tancini G. Five years survival in metastatic non-small cell lung cancer patients treated with chemotherapy alone or chemotherapy and melatonin: A randomized trial. J Pineal Res. 2003;35:12–15. [PubMed] [Google Scholar]
192. Cerea G, Vaghi M, Ardizzoia A, Villa S, Bucovec R, Mengo S, Gardani G, Tancini G, Lissoni P. Biomodulation of cancer chemotherapy for metastatic colorectal cancer: A randomized study of weekly low-dose irinotecan alone versus irinotecan plus the oncostatic pineal hormone melatonin in metastatic colorectal cancer patients progressing on 5-fluorouracil-containing combinations. Anticancer Res. 2003;23:1951–1954. [PubMed] [Google Scholar]
193. Innominato PF, Lim AS, Palesh O, Clemons M, Trudeau M, Eisen A, Wang C, Kiss A, Pritchard KI, Bjarnason GA. The effect of melatonin on sleep and quality of life in patients with advanced breast cancer. Support Care Cancer. 2016;24:1097–1105. [PubMed] [Google Scholar]
194. Hansen MV, Andersen LT, Madsen MT, Hageman I, Rasmussen LS, Bokmand S, Rosenberg J, Gogenur I. Effect of melatonin on depressive symptoms and anxiety in patients undergoing breast cancer surgery: A randomized, double-blind, placebo-controlled trial. Breast Cancer Res Treat. 2014;145:683–695. [PubMed] [Google Scholar]
195. Madsen MT, Hansen MV, Andersen LT, Hageman I, Rasmussen LS, Bokmand S, Rosenberg J, Gogenur I. Effect of melatonin on sleep in the perioperative period after breast cancer surgery: A randomized, double-blind, placebo-controlled trial. J Clin Sleep Med. 2016;12:225–233. [PMC free article] [PubMed] [Google Scholar]
196. Chen WY, Giobbie-Hurder A, Gantman K, Savoie J, Scheib R, Parker LM, Schernhammer ES. A randomized, placebo-controlled trial of melatonin on breast cancer survivors: Impact on sleep, mood, and hot flashes. Breast Cancer Res Treat. 2014;145:381–388. [PMC free article] [PubMed] [Google Scholar]
197. Di Bella G, Mascia F, Ricchi A, Colori B. Evaluation of the safety and efficacy of the first-line treatment with somatostatin combined with melatonin, retinoids, vitamin D3, and low doses of cyclophosphamide in 20 cases of breast cancer: A preliminary report. Neuroendocrinol Lett. 2013;34:660–668. [PubMed] [Google Scholar]
198. Schernhammer ES, Giobbie-Hurder A, Gantman K, Savoie J, Scheib R, Parker LM, Chen WY. A randomized controlled trial of oral melatonin supplementation and breast cancer biomarkers. Cancer Causes Control. 2012;23:609–616. [PMC free article] [PubMed] [Google Scholar]
199. Rasmussen CL, Olsen MK, Johnsen AT, Petersen MA, Lindholm H, Andersen L, Villadsen B, Groenvold M, Pedersen L. Effects of melatonin on physical fatigue and other symptoms in patients with advanced cancer receiving palliative care: A double-blind placebo-controlled crossover trial. Cancer. 2015;121:3727–3736. [PubMed] [Google Scholar]
ЧИТАЙТЕ ТАКЖЕ